题目内容
【题目】常温下,将等浓度的NaOH溶液分别滴加到等pH、等体积的HA、HB两种弱酸溶液中,溶液的pH与粒子浓度比值的对数关系如图所示。下列叙述错误的是( )
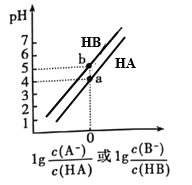
A. a点时,溶液中由水电离的c(OH-)约为1×10-10 mol·L-1
B. 电离平衡常数:Ka(HA)< Ka(HB)
C. b点时,c(B-)=c(HB)>c(Na+)>c(H+)>c(OH-)
D. 向HB溶液中滴加NaOH溶液至pH=7时:c(B-)> c(HB)
【答案】B
【解析】
A. a点时,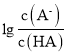 =0,c(A-)=c(HA),溶液为酸和盐的溶合溶液,pH=4,抑制水的电离,溶液中由水电离的c(OH-)约为1×10-10 mol·L-1,选项A正确;
=0,c(A-)=c(HA),溶液为酸和盐的溶合溶液,pH=4,抑制水的电离,溶液中由水电离的c(OH-)约为1×10-10 mol·L-1,选项A正确;
B. 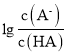 =0,c(A-)=c(HA),电离平衡常数:Ka(HA)=
=0,c(A-)=c(HA),电离平衡常数:Ka(HA)=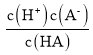 =
=![]() =10-4mol/L;
=10-4mol/L;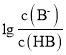 =0,c(B-)=c(HB),电离平衡常数:Ka(HB)=
=0,c(B-)=c(HB),电离平衡常数:Ka(HB)=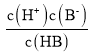 =
=![]() =10-5mol/L,Ka(HA)> Ka(HB),选项B错误;
=10-5mol/L,Ka(HA)> Ka(HB),选项B错误;
C. b点时,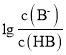 =0,c(B-)=c(HB),pH=5,c(B-)=c(HB)>c(Na+)>c(H+)>c(OH-),选项C正确;
=0,c(B-)=c(HB),pH=5,c(B-)=c(HB)>c(Na+)>c(H+)>c(OH-),选项C正确;
D. 向HB溶液中滴加NaOH溶液至pH=7时,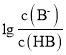 >0,c(B-)> c(HB),选项D正确。
>0,c(B-)> c(HB),选项D正确。
答案选B。

【题目】(1)实验测得5g甲醇在氧气中完全燃烧,生成二氧化碳气体和液态水时释放出113.5 kJ的热量。试写出甲醇燃烧的热化学方程式:___________________________。
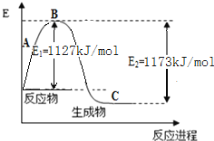
(2)现己知N2(g)和H2(g)反应生成1 molNH3(g)过程中能量变化示意如图。根据下列已知键能数据计算N-H键键能为____________________kJ/mol 。
化学键 | H-H |
|
键能(kJ/mol) | 436 | 946 |
(3)用如图所示装置进行中和热测定实验,请回答下列问题:
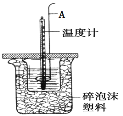
仪器A的名称为 ________________________ 。
取30mLH2SO4(0.5mol·L-1)溶液与50mLNaOH(0.5mol·L-1)溶液在小烧杯中进行中和反应,三次实验温度平均升高4.1℃,已知中和后生成的溶液的比热容为![]() ,溶液的密度均为1g/cm3,通过计算可得中和热 ______ 。(保留小数点后一位)
,溶液的密度均为1g/cm3,通过计算可得中和热 ______ 。(保留小数点后一位)
上述实验数值结果与57.3kJ·mol-1有偏差,产生此偏差的原因可能是(填字母)______。
a.实验装置保温、隔热效果差
b.用温度计测定NaOH溶液起始温度后直接测定H2SO4溶液的温度
c.一次性把NaOH溶液倒入盛有硫酸的小烧杯中
实验中若改用60mLH2SO4(0.25mol·L-1)溶液与50mLNaOH(0.55 mol·L-1)溶液进行反应,与上述实验相比,所放出的热量 ______ (填“相等”、“不相等”),所求中和热 _____ (填“相等”、“不相等”),若用50mL0.5mol·L-1醋酸代替H2SO4溶液进行上述实验,测得反应前后温度的变化值会 ______ (填“偏大”、“偏小”、“不受影响”)。