题目内容
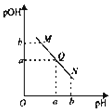
【题目】某课外实验小组利用压强传感器、数据采集器和计算机等数字化实验设备,探究用0.01g镁条分别与2mL不同浓度稀盐酸的反应速率。实验结果如图所示。

(1)Mg与盐酸反应的离子方程式是________。
(2)从微粒角度分析,该实验是为了探究________(因素)对该反应的化学反应速率的影响。
(3)a________0.5(填“>”或“<”)。
(4)如果用0.5mol/L硫酸代替上述实验中的0.5mol/L盐酸,二者的反应速率是否相同____,请说明原因:________。
【答案】Mg+2H+=Mg2++H2↑ 浓度 > 不同 用相同浓度硫酸代替实验中盐酸,导致氢离子浓度增大,化学反应速率加快。
【解析】
根据金属与酸反应原理书写反应方程式;根据影响化学反应速率的因素进行分析解答。
(1 )镁与盐酸反应生成氯化镁和氢气,此反应的离子方程式为:Mg+2H+=Mg2++H2↑,故答案:Mg+2H+=Mg2++H2↑;
(2)实验中其他条件都相同,只有盐酸浓度不同,即氢离子浓度不同,故从微粒角度分析,该实验是为了探究反应物浓度对该反应的化学反应速率的影响,故答案:浓度;
(3 )从图像分析,用a mol/L的盐酸反应速率曲线斜率比0.5mol/L盐酸大,说明用a mol/L的盐酸反应速率更快,反应物浓度大,速率加快,说明a大于0.5 ,故答案: >;
( 4)如果用0.5mol/L的硫酸,则由于1mol硫酸完全电离生成2mol氢离子,氢离子的浓度增大,反应速率加快,因此反应速率不同,故答案:不同;用相同浓度硫酸代替实验中盐酸,导致氢离子浓度增大,化学反应速率加快。

【题目】已知X、Y、Z三种元素均为短周期元素,原子序数依次递增,Q、W为前30号元素。5种元素的部分特点:
元素 | 特点 |
X | 其气态氢化物呈三角锥形,水溶液显碱性 |
Y | 基态原子核外有三个能级,其中最外层电子数等于次外层电子数的3倍 |
Z | 元素原子的外围电子层排布式为nsn-1npn-1 |
Q | 被誉为“太空金属”、“生物金属”,其基态原子最高能级有3个空轨道 |
W | 原子M能层为全充满状态且核外的未成对电子只有一个 |
(1)XF3分子中X的杂化类型为______,该分子的空间构型为_______。
(2)基态Q原子的电子排布式为_____________________,第一电离能:X______Y(填“>” “<”或“=”)。
(3)X、Y、Z电负性由大到小的顺序为____________(用元素符号表示)。
(4)Na在Y2中燃烧产物的电子式为________________。
(5)Z和X形成的化合物常用作高温耐火材料,化学性质稳定,据此推测它应属于_______晶体。
(6)W元素与X元素形成某种化合物的晶胞结构如图所示(黑球代表W原子),若该晶体的密度为ρ g·cm-3,则该晶胞的体积是__________cm3。

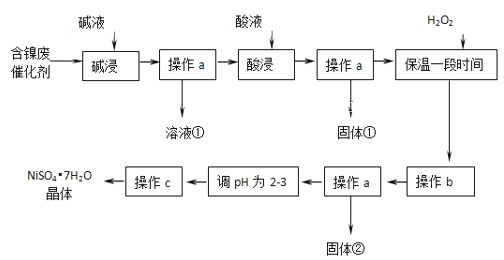
【题目】某化学研究性学习小组通过查阅资料,设计了如图所示的方法以含镍废催化剂为原料来制备NiSO47H2O。已知某化工厂的含镍催化剂主要含有Ni,还含有Al(31%)、Fe(1.3%)的单质及氧化物,其他不溶杂质(3.3%)。
部分阳离子以氢氧化物形式完全沉淀时的pH如下:
沉淀物 | Al(OH)3 | Fe(OH)3 | Fe(OH)2 | Ni(OH)2 |
pH | 5.2 | 3.2 | 9.7 | 9.2 |
回答下列问题:
(1)操作a、c中需使用的仪器除铁架台(带铁圈)、酒精灯、烧杯、玻璃棒外还需要的主要仪器为___。
(2)“碱浸”过程中发生的离子方程式是___。
(3)“酸浸”时所加入的酸是___(填化学式).酸浸后,经操作a分离出固体①后,溶液中可能含有的金属离子是___。
(4)操作b为调节溶液的pH,你认为pH的最佳调控范围是___。
(5)“调pH为2~3”的目的是___。
(6)产品晶体中有时会混有少量绿矾(FeSO47H2O),其原因可能是__ 、___。