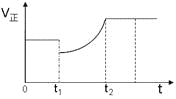
题目内容
【题目】![]() 时,下列有关电解质溶液说法正确的是
时,下列有关电解质溶液说法正确的是![]()
![]()
A.稀醋酸中加入冰醋酸,醋酸电离平衡右移,电离度增大
B.向NaF溶液中滴加硫酸至中性时,![]()
C.向氨水中加入![]() 固体,溶液中
固体,溶液中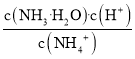 增大
增大
D.AgCl在水和NaCl溶液中的溶度积分别为![]() 、
、![]() ,则
,则![]()
【答案】B
【解析】
A.稀醋酸中加入冰醋酸,醋酸电离平衡右移,但电离度减小,故A错误;
B.向NaF溶液中滴加硫酸至中性时,溶液中物料守恒为:c(Na+)=c(HF)+c(F-),电荷守恒为c(Na+)+c(H+)=c(OH-)+c(F-)+2c(SO42-),消去钠离子的浓度可得:c(HF)+c(H+)=c(OH-)+2c(SO42-),溶液显中性,则c(H+)=c(OH-),所以c(HF)=2c(SO42-),则c(SO42-)<c(HF),故B正确;
C.铵根离子的水解常数Kh=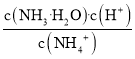 ,溶液的温度不变,水解常数不变,故C错误;
,溶液的温度不变,水解常数不变,故C错误;
D.溶度积只与温度有关,与溶液的浓度无关,所以AgCl在水和NaCl溶液中的溶度积分别为K1、K2,则K1=K2,故D错误;
故答案为B。

 暑假作业海燕出版社系列答案
暑假作业海燕出版社系列答案 本土教辅赢在暑假高效假期总复习云南科技出版社系列答案
本土教辅赢在暑假高效假期总复习云南科技出版社系列答案 暑假作业北京艺术与科学电子出版社系列答案
暑假作业北京艺术与科学电子出版社系列答案 第三学期赢在暑假系列答案
第三学期赢在暑假系列答案【题目】(1)实验测得5g甲醇在氧气中完全燃烧,生成二氧化碳气体和液态水时释放出113.5 kJ的热量。试写出甲醇燃烧的热化学方程式:___________________________。
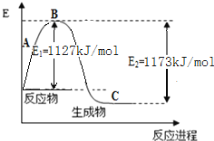
(2)现己知N2(g)和H2(g)反应生成1 molNH3(g)过程中能量变化示意如图。根据下列已知键能数据计算N-H键键能为____________________kJ/mol 。
化学键 | H-H |
|
键能(kJ/mol) | 436 | 946 |
(3)用如图所示装置进行中和热测定实验,请回答下列问题:
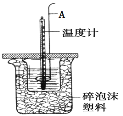
仪器A的名称为 ________________________ 。
取30mLH2SO4(0.5mol·L-1)溶液与50mLNaOH(0.5mol·L-1)溶液在小烧杯中进行中和反应,三次实验温度平均升高4.1℃,已知中和后生成的溶液的比热容为![]() ,溶液的密度均为1g/cm3,通过计算可得中和热 ______ 。(保留小数点后一位)
,溶液的密度均为1g/cm3,通过计算可得中和热 ______ 。(保留小数点后一位)
上述实验数值结果与57.3kJ·mol-1有偏差,产生此偏差的原因可能是(填字母)______。
a.实验装置保温、隔热效果差
b.用温度计测定NaOH溶液起始温度后直接测定H2SO4溶液的温度
c.一次性把NaOH溶液倒入盛有硫酸的小烧杯中
实验中若改用60mLH2SO4(0.25mol·L-1)溶液与50mLNaOH(0.55 mol·L-1)溶液进行反应,与上述实验相比,所放出的热量 ______ (填“相等”、“不相等”),所求中和热 _____ (填“相等”、“不相等”),若用50mL0.5mol·L-1醋酸代替H2SO4溶液进行上述实验,测得反应前后温度的变化值会 ______ (填“偏大”、“偏小”、“不受影响”)。