题目内容
12.质的类别和核心元素的化合价是研究物质性质的两个基本视角.根据图,完成下列填空:
(1)如图中X的电子式为
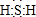 ;其水溶液长期在空气中放置容易变浑浊,用化学方程式表示该变化2H2S+O2 =2S↓+2H2O;该变化体现出硫元素的非金属性比氧元素弱(填“强”或“弱”).用原子结构解释原因氧和硫同主族,同主族元素最外层电子数相同,从上到下,电子层数增多,原子半径增大,得电子能力逐渐减弱.
;其水溶液长期在空气中放置容易变浑浊,用化学方程式表示该变化2H2S+O2 =2S↓+2H2O;该变化体现出硫元素的非金属性比氧元素弱(填“强”或“弱”).用原子结构解释原因氧和硫同主族,同主族元素最外层电子数相同,从上到下,电子层数增多,原子半径增大,得电子能力逐渐减弱.(2)Na2S2O3是一种用途广泛的钠盐.下列物质用于Na2S2O3的制备,从氧化还原反应的角度,理论上有可能的是bd(填字母序号).
a.Na2S+S b.Z+S c.Na2SO3+Y d.NaHS+NaHSO3
(3)SO2是主要大气污染物之一.工业上烟气脱硫的方法之一是用碱液吸收,其流程如图:
 .该法吸收快,效率高.若在操作中持续通入含SO2的烟气,则最终产物为NaHSO3.室温下,0.1mol/L ①亚硫酸钠 ②亚硫酸氢钠 ③硫化钠 ④硫化氢钠的四种溶液的pH由大到小的顺序是③>①>④>②.(用编号表示)
.该法吸收快,效率高.若在操作中持续通入含SO2的烟气,则最终产物为NaHSO3.室温下,0.1mol/L ①亚硫酸钠 ②亚硫酸氢钠 ③硫化钠 ④硫化氢钠的四种溶液的pH由大到小的顺序是③>①>④>②.(用编号表示)已知:H2S:Ki1=1.3×10-7 Ki2=7.1×10-15 H2SO3:Ki1=1.3×10-2 Ki2=6.2×10-8
(4)治理含CO、SO2的烟道气,也可以将其在催化剂作用下转化为单质S和无毒的气体:
2CO(g)+SO2 (g)?S(s)+2CO2(g).一定条件下,将CO与SO2以体积比为4:1置于恒容密闭容器中发生上述反应,下列选项能说明反应达到平衡状态的是cd(填写字母序号).
a.v (CO):v(SO2)=2:1
b.平衡常数不变
c.气体密度不变
d.CO2和SO2的体积比保持不变
测得上述反应达平衡时,混合气体中CO的体积分数为$\frac{7}{11}$,则SO2的转化率为60%.
分析 (1)X为H2S,S最外层6个电子,能够与2个H原子形成共价键;H2S在空气中变浑浊是因为被氧气氧化为S;同主族元素最外层电子数相同,原子半径自上而下逐渐增大,得电子能力逐渐减弱,失电子能力逐渐增强;
(2)Na2S2O3中S为+2价,从氧化还原的角度分析,反应物中S元素化合价必须分别大于2和小于2;
(3)持续通入含SO2的烟气,与NaOH反应生成亚硫酸氢钠;酸性越弱,水解程度越大,则溶液碱性越强,pH越大;
(4)结合平衡的特征“等”、“定”及衍生的物理量判断平衡状态;测得上述反应达平衡时,混合气体中CO的体积分数为$\frac{7}{11}$,则
2CO(g)+SO2 (g)═S(s)+2CO2(g)
反应前(mol) 4 1 0 0
转化了(mol) 2x x x 2x
平衡后(mol)4-2x 1-x x 2x
混合气体中CO的体积分数为$\frac{7}{11}$,则有$\frac{4-2x}{4-2x+1-x+2x}$=$\frac{7}{11}$,x=0.6,以此计算转化率.
解答 解:(1)X为H2S,S最外层6个电子,能够与2个H原子形成共价键,其电子式为: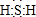 ;H2S在空气中变浑浊是因为被氧气氧化为S,反应为2H2S+O2 →2S↓+2 H2O,所以S非金属性比O弱,从结构上可知,氧和硫同主族,同主族元素最外层电子数相同,从上到下,电子层数增多,原子半径增大,得电子能力逐渐减弱,
;H2S在空气中变浑浊是因为被氧气氧化为S,反应为2H2S+O2 →2S↓+2 H2O,所以S非金属性比O弱,从结构上可知,氧和硫同主族,同主族元素最外层电子数相同,从上到下,电子层数增多,原子半径增大,得电子能力逐渐减弱,
故答案为: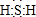 ;2H2S+O2 =2S↓+2 H2O;弱;氧和硫同主族,同主族元素最外层电子数相同,从上到下,电子层数增多,原子半径增大,得电子能力逐渐减弱;
;2H2S+O2 =2S↓+2 H2O;弱;氧和硫同主族,同主族元素最外层电子数相同,从上到下,电子层数增多,原子半径增大,得电子能力逐渐减弱;
(2)①Na2S2O3中S为+2价,从氧化还原的角度分析,反应物中S元素化合价必须分别大于2和小于2,a中S化合价都小于2,c中S的化合价都大于2,bd符合题意,
故答案为:bd;
(3)持续通入含SO2的烟气,与NaOH反应,气体过量生成NaHSO3;由电离平衡常数可知,酸性为HS-<HSO3-<H2S<H2SO3,则盐溶液的pH为③>①>④>②,
故答案为:NaHSO3;③>①>④>②;
(4)a.v (CO):v(SO2)=2:1,速率之比始终等于化学计量数之比,其无法判断反应是否达到平衡状态,故a错误;
b.温度不变平衡常数始终不变,平衡常数不变不能说明反应达到平衡状态,故b错误;
c.容器体积不变,S为固态,反应正向进行气体体积减小,当气体质量不变时,说明各组分浓度不变,反应达到平衡状态,故c正确;
d.CO2和SO2的体积比保持不变说明正逆反应速率相等,反应达到平衡状态,故d正确;
由 2CO(g)+SO2 (g)═S(s)+2CO2(g)
反应前(mol) 4 1 0 0
转化了(mol) 2x x x 2x
平衡后(mol)4-2x 1-x x 2x
混合气体中CO的体积分数为$\frac{7}{11}$,则有$\frac{4-2x}{4-2x+1-x+2x}$=$\frac{7}{11}$,x=0.6,
所以SO2的转化率为$\frac{0.6}{1}$×100%=60%,
故答案为:cd;60%.
点评 本题考查较综合,涉及非金属性比较、氧化还原反应、反应速率及热化学方程式等,侧重反应原理中高频考点的考查,综合性较强,题目难度不大.

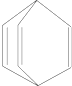
| A. | 桶烯在一定条件下能发生加聚反应 | |
| B. | 桶烯与苯乙烯(C6H5CH═CH2)互为同分异构体 | |
| C. | 桶烯中的一个氢原子被氯原子取代,所得产物只有两种 | |
| D. | 桶烯分子中所有的原子在同一平面上 |
| A. | 氨水和氢氧化钠 | B. | 硫酸铵和氯化钡 | C. | 硝酸亚铁和盐酸 | D. | 电石和盐酸 |
| A. | 由C(s,石墨)→C(s,金刚石)-1.9 kJ,可知:石墨比金刚石更稳定 | |
| B. | 等质量的硫蒸气和硫固体分别完全燃烧,后者放出的热量更多 | |
| C. | 由H+(aq)+OH-(aq)→H2O(l)+57.3 kJ,可知:含1 mol CH3COOH的溶液与含1 mol NaOH的溶液混合,放出热量等于57.3 kJ | |
| D. | 2 g H2完全燃烧生成液态水放出285.8 kJ热量,则氢气燃烧的热化学方程式为2H2(g)+O2(g)→2H2O(l)+285.8 kJ |
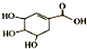
| A. | 分子式为C7H6O5 | B. | 可发生取代反应 | ||
| C. | 可使酸性高锰酸钾溶液褪色 | D. | 不能与溴水发生加成反应 |
| A. | 矿物油和植物油都可以通过石油分馏来获取 | |
| B. | 硫酸亚铁可作补血剂组成成分 | |
| C. | 蛋白质的水解产物都是α-氨基酸 | |
| D. | 造成PM2.5的直接原因是土壤沙漠化 |
 →CH3-CHO+H2O
→CH3-CHO+H2O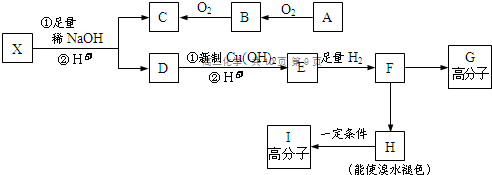
 ;F→H的反应类型是消去反应.
;F→H的反应类型是消去反应. .
. .
.