题目内容
16.某种烷烃11g完全燃烧时,需要28L氧气(标准状况下),该烷烃是( )| A. | C5Hl2 | B. | C4H10 | C. | C3H8 | D. | C2H6 |
分析 根据n=$\frac{V}{{V}_{m}}$计算出标准状况下2.8L该烷烃的物质的量,设烷烃分子式为CnH2n+2,然后利用烷烃的燃烧通式列式计算出n即可.
解答 解:标准状况下28L氧气的物质的量为:$\frac{28L}{22.4L/mol}$=1.25mol,设烷烃分子式为CnH2n+2,则
CnH2n+2 +(n+$\frac{2n+2}{4}$)O2$\stackrel{点燃}{→}$nCO2+(n+1)H2O
(14n+2)g (n+$\frac{2n+2}{4}$)mol
11g 1.25mol
(14n+2)g×1.25mol=11g×(n+$\frac{2n+2}{4}$)mol,
解得:n=3,
所以该烷烃分子式为C3H8.
故选C.
点评 本题考查有机物分子式的确定,题目难度不大,正确书写烷烃的燃烧通式为解答关键,试题侧重考查学生的分析能力及化学计算能力.

练习册系列答案
相关题目
6.1g O2中含有m个分子,则阿伏加德罗常数的值用m可表示为( )
| A. | $\frac{m}{16}$ | B. | 16m | C. | $\frac{m}{32}$ | D. | 32m |
7.下列关于反应能量的说法正确的是( )
| A. | Zn(s)+CuSO4(aq)═ZnSO4(aq)+Cu(s)△H=-216kJ•mol-1,则反应物总能量>生成物总能量 | |
| B. | 相同条件下,如果1mol氢原子所具有的能量为E1,1mol 氢分子所具有的能量为E2,则2E1=E2 | |
| C. | 101 kPa时,2H2(g)+O2(g)═2H2O(l)△H=-571.6 kJ•mol-1,则H2的燃烧热为△H=-571.6 kJ•mol-1 | |
| D. | H+(aq)+OH-(aq)═H2O(l)△H=-57.3 kJ•mol-1,则1molNaOH的氢氧化钠固体与含0.5molH2SO4的稀硫酸混合后放出57.3kJ的热量 |
4.某组成为C3H5O2C1的纯净有机物A与Na0H水溶液共热,产物酸化后可得到分子组成为C3H6O3的有机物B,在适当条件下,每两分子的B可相互发生酯化反应,生成1分子C,那么C的结构不可能是( )
| A. | CH3CH(OH)C00CH(CH3)C00H | B. | CH3CH(OH)C00CH2CH2C00H | ||
| C. | 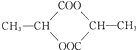 | D. | 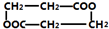 |
11.下列关于物质性质变化的比较,不正确的是( )
| A. | 酸性:HI>HBr>HCl>HF | B. | 沸点:HI>HBr>HCl>HF | ||
| C. | 还原性:HI>HBr>HCl>HF | D. | 热稳定:HF>HCl>HBr>HI |
1.将CaCl2和CaBr2的混合物13.400g溶于水配成500.00mL溶液,再通入过量的Cl2,完全反应后将溶液蒸干,得到干燥固体11.175g.则原配溶液中c(Ca2+):c(Cl-):c(Br-)为( )
| A. | 3:2:1 | B. | 1:2:3 | C. | 1:3:2 | D. | 2:3:1 |
8.NA代表阿伏伽德罗常数的值.下列叙述正确的是( )
| A. | 1mol的羟基与1mol的氢氧根离子所含电子数均为9NA | |
| B. | 120g NaHSO4固体中含有的离子总数为3NA | |
| C. | 1mol Na被氧化生成Na2O2或NaCl,都失去NA个电子 | |
| D. | 1.0L 1.0mol•L-1的NaNO3水溶液中含有的氧原子数为3NA |
13.研究反应物的化学计量数与产物之间的关系时,使用类似数轴的方法可以收到的直观形象的效果.下列表达不正确的是( )
| A. | CO2通入澄清的石灰水中反应的产物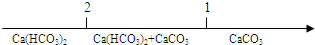 $\frac{n(C{O}_{2})}{n[Ca(OH)_{2}]}$ $\frac{n(C{O}_{2})}{n[Ca(OH)_{2}]}$ | |
| B. | Fe在Cl2中的燃烧产物: $\frac{n(C{l}_{2})}{n(Fe)}$ $\frac{n(C{l}_{2})}{n(Fe)}$ | |
| C. | AlCl3溶液中滴加NaOH后铝的存在形式: $\frac{n(NaOH)}{n(AlC{l}_{3})}$ $\frac{n(NaOH)}{n(AlC{l}_{3})}$ | |
| D. | 氨水与SO2反应后溶液中的铵盐: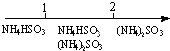 $\frac{n(N{H}_{3}{H}_{2}O)}{n(S{O}_{2})}$11 $\frac{n(N{H}_{3}{H}_{2}O)}{n(S{O}_{2})}$11 |