题目内容
6.1g O2中含有m个分子,则阿伏加德罗常数的值用m可表示为( )| A. | $\frac{m}{16}$ | B. | 16m | C. | $\frac{m}{32}$ | D. | 32m |
分析 结合n=$\frac{m}{M}$、NA=$\frac{N}{n}$计算.
解答 解:n(O2)=$\frac{1g}{32g/mol}$=$\frac{1}{32}$mol,
则1g O2中含有m个分子,则阿伏加德罗常数为$\frac{m}{\frac{1}{32}mol}$=32m mol-1,
故选D.
点评 本题考查物质的量的计算,为高频考点,把握物质的量为中心的基本计算公式及物质的构成为解答的关键,侧重分析与计算能力的考查,题目难度不大.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
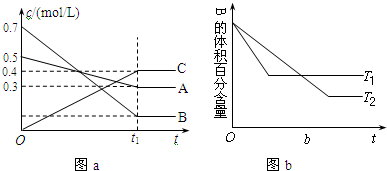
17.T℃时,在容积恒定的密闭容器中A气体与B气体反应生成C气体,反应过程中A、B、C浓度的变化如图a所示,若保持其他条件不变,温度分别为T1和T2时,B的体积百分含量与时间的关系如图b所示,则下列结论正确的是
( )
( )

| A. | 其他条件不变,升高温度,正、逆反应速率均增大,且A的转化率增大 | |
| B. | T℃时,若在该容器中由0.4mol/LA、0.4mol/LB和0.2mol/LC反应,达到平衡后,C的浓度仍为0.4mol/L | |
| C. | 在(t1+10)min时,保持其他条件不变,增大压强,平衡向逆反应方向移动 | |
| D. | (t1+10)min时,保持压强不变,通入稀有气体,平衡向正反应方向移动 |
1.下列粒子的半径最大的是( )
| A. | Na | B. | S | C. | O | D. | Cl |
18.由物质的分类知识可知,下列生活中常见的物质属于同一类的是( )
| A. | 铝合金、钢 | B. | 加碘食盐、纯碱 | C. | 冰水、冰镇汽水 | D. | 氧气、空气 |
16.某种烷烃11g完全燃烧时,需要28L氧气(标准状况下),该烷烃是( )
| A. | C5Hl2 | B. | C4H10 | C. | C3H8 | D. | C2H6 |