题目内容
11.下列关于物质性质变化的比较,不正确的是( )| A. | 酸性:HI>HBr>HCl>HF | B. | 沸点:HI>HBr>HCl>HF | ||
| C. | 还原性:HI>HBr>HCl>HF | D. | 热稳定:HF>HCl>HBr>HI |
分析 A.卤素原子,结合质子能力越强,酸性越弱;
B.HF中含氢键,沸点最高,其它氢化物中相对分子质量大的沸点高;
C.元素非金属性越强,对应离子的还原性越弱;
D.元素的非金属性越强,对应的氢化物越稳定.
解答 解:A.卤素原子,结合质子能力越强,酸性越弱,故酸性HI>HBr>HCl>HF,故A正确;
B.HF中含氢键,沸点最高,其它氢化物中相对分子质量大的沸点高,则沸点为HF>HI>HBr>HCl,故B错误;
C.元素非金属性越强,对应离子的还原性越弱,所以I->Br->Cl->F-,即还原性:HI>HBr>HCl>HF,故C正确;
D.非金属性:F>Cl>Br>I,元素的非金属性越强,对应的氢化物越稳定,故D正确;故选B.
点评 本题综合考查元素周期律知识,为高考常见题型和高频考点,侧重于学生的分析能力的考查,注意相关基础知识的积累,难度不大.

练习册系列答案
相关题目
1.下列粒子的半径最大的是( )
| A. | Na | B. | S | C. | O | D. | Cl |
19.NA为阿伏加德罗常数,下列说法正确的是( )
| A. | 标准状况下,11.2L的戊烷所含的分子数为0.5NA | |
| B. | 26g乙炔所含共用电子对数目为3NA | |
| C. | 标准状况下,11.2 L CCl4所含分子数为0.5NA | |
| D. | 现有乙烯、丙烯、丁烯的混合气体共14g,其原子数为3NA |
16.某种烷烃11g完全燃烧时,需要28L氧气(标准状况下),该烷烃是( )
| A. | C5Hl2 | B. | C4H10 | C. | C3H8 | D. | C2H6 |
3.三氟化氮(NH3)是一种无色无味的气味,它是氨气(NH3)和氟(F2)在一定条件下发生反应4NH3+3F2═NF3+3NH4F得到的.下列关于NF3的叙述正确的是( )
| A. | NF3中N呈+3价 | B. | NF3的还原性比NH3强 | ||
| C. | NF3的氧化性比F2强 | D. | NF3是离子化合物 |
20.下列有关化学用语表示正确的( )
| A. | N2的电子式:N??N | |
| B. | S2-的结构示意图: | |
| C. | 质子数为53,中子数为78的碘原子:${\;}_{53}^{131}$I | |
| D. | 苯的最简式:C6H6 |
8.我国古代的各种技术中,其工作原理不涉及化学反应的是( )
| A. | 使用火药 | B. | 用粮食酿酒 | C. | 用纺线车纺线 | D. | 铁的冶炼 |
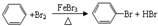 ,预测该芳香烃能(填“能”或“不能”)发生该类反应.
,预测该芳香烃能(填“能”或“不能”)发生该类反应. b.
b.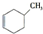 c.
c.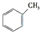
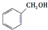 c.
c.

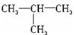 .
.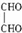 .
.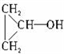 .
.