题目内容
5.有机物A是烃的含氧有机物,在同温同压下,A蒸气的质量是同体积乙醇蒸气的2倍.1.38gA完全燃烧后,将燃烧产物通过碱石灰,碱石灰的质量增加3.06 g.若将燃烧后的产物通过浓硫酸,浓硫酸的质量增加1.08g.若取4.6gA与足量的金属Na反应,在标准状况下生成1.68L氢气,A与Na2CO3溶液混合不反应.(1)求A的相对分子质量;
(2)求A的分子式;
(3)求A的结构简式.
分析 (1)相同条件下气体的密度与相对分子量成正比,根据“在同温同压下,A蒸气的质量是同体积乙醇蒸气的2倍”可确定A的相对分子量;
(2)碱石灰增重的是水和二氧化碳的质量,浓硫酸增重的是水的质量,据此可确定该有机物燃烧生成二氧化碳和水的质量、物质的量,再利用质量守恒定律确定其分子式;
(3)根据该有机物具有的性质判断其含有的官能团类型,然后确定其结构简式.
解答 解:(1)A蒸气的质量是同体积乙醇蒸气的2倍,即:相同条件下A的密度是乙醇密度的2倍,则A的相对分子质量为:46×2=92,
答:A的相对分子质量为92;
(2)1.38gA完全燃烧后,生成水的质量=1.08克,其物质的量=$\frac{1.08g}{18g/mol}$=0.06mol,生成CO2的质量=3.06-1.08=1.98g,其物质的量=$\frac{1.98g}{44g/mol}$=0.045mol,
1.38gA的物质的量为:$\frac{1.38g}{92g/mol}$=0.015mol,
故有机物A分子中C原子数目=$\frac{0.045mol}{0.015mol}$=3、H原子数目=$\frac{0.06mol×2}{0.015mol}$=8、O原子数目=$\frac{92-12×3-8}{16}$=3,
故有机物A的分子式为C3H8O3,
答:A的分子式为C3H8O3;
(3)取4.6gA的物质的量为0.05mol,与足量的金属钠反应,生成的气体在标准状况下的体积为1.68L,即氢气的物质的量为:$\frac{1.68L}{22.4L/mol}$=0.075mol,A不与纯碱反应,则A没有-COOH,故有机物A含有-OH,羟基数目为:$\frac{0.075mol×2}{0.05mol}$=3,
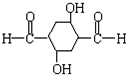
故A的结构简式为: ,
,
答:A的结构简式为 .
.
点评 本题考查有机物分子式与结构确定,题目难度中等,属于计算型推断,根据原子守恒确定有机物分子式是关键,注意掌握常见有机物官能团的性质.

 黄冈天天练口算题卡系列答案
黄冈天天练口算题卡系列答案| A. | C5Hl2 | B. | C4H10 | C. | C3H8 | D. | C2H6 |
| A. | 6种 | B. | 5种 | C. | 4种 | D. | 3种 |
| A. | N2的电子式:N??N | |
| B. | S2-的结构示意图: | |
| C. | 质子数为53,中子数为78的碘原子:${\;}_{53}^{131}$I | |
| D. | 苯的最简式:C6H6 |
| A. | AgNO3 | B. | H2SO4 | C. | BaCl2 | D. | NaOH |
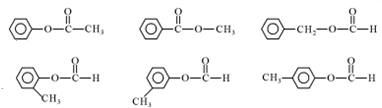
| A. | 苯分子的核磁共振图表明分子中只存在一种氢原子 | |
| B. | 邻二甲苯没有同分异构体 | |
| C. | 间二甲苯没有同分异构体 | |
| D. | 对二甲苯没有同分异构体 |
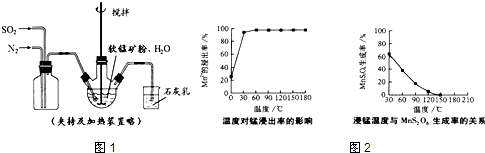
①缓慢向烧瓶中(见图1)通入过量混合气进行“浸锰”操作,主要反应原理为:SO2+H2O=H2SO3;MnO2+H2SO3=MnSO4+H2O(铁浸出后,过量的SO2会将Fe3+还原为Fe2+)
②向“浸锰”结束后的烧瓶中加入一定量纯MnO2粉末.
③再用Na2CO3溶液调节pH为3.5左右,过滤.
④调节滤液pH为6.5~7.2,加入NH4HCO3,有无色无味的气体放出,同时有浅红色的沉淀生成,经过滤、洗涤、干燥,得到高纯碳酸锰.请回答:
(1)石灰乳参与反应的化学方程式为Ca(OH)2+SO2═CaSO3+H2O.
(2)“浸锰”反应中往往有副产物MnS2O6的生成,温度对“浸锰”反应的影响如图2,为减少MnS2O6 的生成,“浸锰”过程适宜的温度是150℃(或150℃以上).
(3)查阅下表回答②中加入一定量纯MnO2粉末的主要作用是将Fe2+氧化为Fe3+,将过量的SO2氧化除去.
| 物质 | Fe(OH)3 | Fe(OH)2 | Mn(OH)2 | Cu(OH)2 |
| 开始沉淀pH | 2.7 | 7.6 | 8.3 | 4.7 |
| 完全沉淀pH | 3.7 | 9.6 | 9.8 | 6.7 |
(5)④中加入NH4HCO3后发生反应的离子方程式是Mn2++2HCO3-=MnCO3↓+CO2↑+H2O.
(6)已知MnCO3难溶于水和乙醇,潮湿时易被空气氧化,100℃开始分解.请问用少量C2H5OH洗涤的原因是防止MnCO3潮湿时被空气氧化、便于在温度低于100℃干燥等.


 .
. (其中任一种).
(其中任一种).