题目内容
13.研究反应物的化学计量数与产物之间的关系时,使用类似数轴的方法可以收到的直观形象的效果.下列表达不正确的是( )| A. | CO2通入澄清的石灰水中反应的产物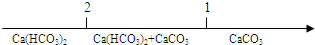 $\frac{n(C{O}_{2})}{n[Ca(OH)_{2}]}$ $\frac{n(C{O}_{2})}{n[Ca(OH)_{2}]}$ | |
| B. | Fe在Cl2中的燃烧产物: $\frac{n(C{l}_{2})}{n(Fe)}$ $\frac{n(C{l}_{2})}{n(Fe)}$ | |
| C. | AlCl3溶液中滴加NaOH后铝的存在形式: $\frac{n(NaOH)}{n(AlC{l}_{3})}$ $\frac{n(NaOH)}{n(AlC{l}_{3})}$ | |
| D. | 氨水与SO2反应后溶液中的铵盐: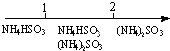 $\frac{n(N{H}_{3}{H}_{2}O)}{n(S{O}_{2})}$11 $\frac{n(N{H}_{3}{H}_{2}O)}{n(S{O}_{2})}$11 |
分析 A.根据发生的反应Ca(OH)2+CO2═CaCO3↓+H2O;CaCO3+CO2+H2O═Ca(HCO3)2分析;
B.Fe在Cl2中燃烧的产物与Fe和Cl2的用量无关,其产物只有FeCl3;
C.根据可能发生的反应Al3++3OH-=Al(OH)3↓,Al3++4OH-=AlO2-+2H2O分析;
D.根据可能发生的反应有:NH3•H2O+SO2=NH4HSO3,2NH3•H2O+SO2=(NH4)2SO3+H2O进行分析.
解答 解:A.反应的化学方程式:Ca(OH)2+CO2═CaCO3↓+H2O;CaCO3+CO2+H2O═Ca(HCO3)2,CO2与Ca(OH)2的物质的量之比为1:1时,恰好反应生成CaCO3,即CO2与Ca(OH)2的物质的量之比为≤1时反应得到CaCO3,CO2与Ca(OH)2的物质的量之比为2:1时,恰好反应生成Ca(HCO3)2,即CO2与Ca(OH)2的物质的量之比为≥2时反应得到Ca(HCO3)2,故A错误;
B.Fe在Cl2中燃烧只有一种产物FeCl3,产物与$\frac{n(C{l}_{2})}{n(Fe)}$无关,故B错误;
C.Al3++3OH-=Al(OH)3↓,Al3++4OH-=AlO2-+2H2O,$\frac{n(NaOH)}{n(AlC{l}_{3})}$<3,铝元素以Al3+和Al(OH)3形式存在; $\frac{n(NaOH)}{n(AlC{l}_{3})}$=3,则以Al(OH)3形式存在;3<$\frac{n(NaOH)}{n(AlC{l}_{3})}$<4以 AlO2-和Al(OH)3形式存在; $\frac{n(NaOH)}{n(AlC{l}_{3})}$≥4只以 AlO2-形式存在,故C正确;
D.NH3•H2O+SO2=NH4HSO3,2NH3•H2O+SO2=(NH4)2SO3+H2O,$\frac{n(N{H}_{3}{H}_{2}O)}{n(S{O}_{2})}$≤1,生成NH4HSO3;1<$\frac{n(N{H}_{3}{H}_{2}O)}{n(S{O}_{2})}$<2,产物为NH4HSO3与(NH4)2SO3混合物;$\frac{n(N{H}_{3}{H}_{2}O)}{n(S{O}_{2})}$≥2,只生成(NH4)2SO3,故D正确.
故选AB.
点评 本题是近年以来出现的一道很少出现的试题题型题,是一道新情景试题,具有很强的综合性,也具有极强的迷惑性,各选项具有很强的干扰性,是一道好题!很容易选错答案.主要考查学生对元素化合物知识的掌握情况.注意Fe在Cl2中燃烧的产物与Fe和Cl2的用量无关,其产物只有FeCl3.

 天天向上口算本系列答案
天天向上口算本系列答案| A. | C5Hl2 | B. | C4H10 | C. | C3H8 | D. | C2H6 |
| A. | 苯分子的核磁共振图表明分子中只存在一种氢原子 | |
| B. | 邻二甲苯没有同分异构体 | |
| C. | 间二甲苯没有同分异构体 | |
| D. | 对二甲苯没有同分异构体 |
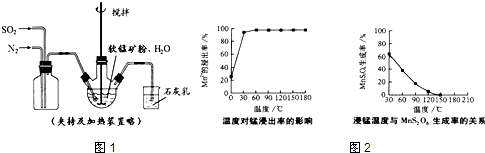
①缓慢向烧瓶中(见图1)通入过量混合气进行“浸锰”操作,主要反应原理为:SO2+H2O=H2SO3;MnO2+H2SO3=MnSO4+H2O(铁浸出后,过量的SO2会将Fe3+还原为Fe2+)
②向“浸锰”结束后的烧瓶中加入一定量纯MnO2粉末.
③再用Na2CO3溶液调节pH为3.5左右,过滤.
④调节滤液pH为6.5~7.2,加入NH4HCO3,有无色无味的气体放出,同时有浅红色的沉淀生成,经过滤、洗涤、干燥,得到高纯碳酸锰.请回答:
(1)石灰乳参与反应的化学方程式为Ca(OH)2+SO2═CaSO3+H2O.
(2)“浸锰”反应中往往有副产物MnS2O6的生成,温度对“浸锰”反应的影响如图2,为减少MnS2O6 的生成,“浸锰”过程适宜的温度是150℃(或150℃以上).
(3)查阅下表回答②中加入一定量纯MnO2粉末的主要作用是将Fe2+氧化为Fe3+,将过量的SO2氧化除去.
| 物质 | Fe(OH)3 | Fe(OH)2 | Mn(OH)2 | Cu(OH)2 |
| 开始沉淀pH | 2.7 | 7.6 | 8.3 | 4.7 |
| 完全沉淀pH | 3.7 | 9.6 | 9.8 | 6.7 |
(5)④中加入NH4HCO3后发生反应的离子方程式是Mn2++2HCO3-=MnCO3↓+CO2↑+H2O.
(6)已知MnCO3难溶于水和乙醇,潮湿时易被空气氧化,100℃开始分解.请问用少量C2H5OH洗涤的原因是防止MnCO3潮湿时被空气氧化、便于在温度低于100℃干燥等.
| A. | 使用火药 | B. | 用粮食酿酒 | C. | 用纺线车纺线 | D. | 铁的冶炼 |
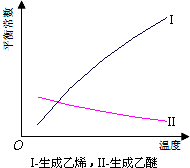 乙醇脱水反应在不同温度条件下得到的产物组成不同.表是常压、某催化剂存在条件下,分别以等量乙醇在不同温度下进行脱水实验获得的数据,每次实验反应时间均相同.
乙醇脱水反应在不同温度条件下得到的产物组成不同.表是常压、某催化剂存在条件下,分别以等量乙醇在不同温度下进行脱水实验获得的数据,每次实验反应时间均相同.| 温度(℃) | 乙醇转化率(%) | 有机产物含量(体积分数) | |
| 乙烯(%) | 乙醚(%) | ||
| 125 | 20 | 8.7 | 90.2 |
| 150 | 68 | 16.7 | 82.2 |
| 175 | 88 | 32.3 | 66.8 |
| 200 | 90 | 86.9 | 12.1 |
(1)乙醇脱水制乙烯的反应是吸热(填“放热”、“吸热”)反应,若增大压强,平衡逆向(选填“正向”、“逆向”、“不”)移动;
(2)已知:150℃时,1mol乙醇蒸汽脱水转变为1mol乙烯,反应热的数值为46KJ,写出该反应的热化学方程式C2H5OH(g)→C2H4(g)+H2O(g)△H=+46KJ/mol;
(3)写出乙醇脱水制乙醚的反应的平衡常数表达式K=$\frac{[C{\;}_{2}H{\;}_{5}OC{\;}_{2}H{\;}_{5}]•[H{\;}_{2}O]}{[C{\;}_{2}H{\;}_{5}OH]{\;}^{2}}$.当乙醇起始浓度相同时,平衡常数K值越大,表明ab(填字母).
a.乙醇的转化率越高 b.反应进行得越完全
c.达到平衡时乙醇的浓度越大 d.化学反应速率越快
(4)根据表中数据分析,150℃时乙醇催化脱水制取的乙醚产量大于(选填“大于”、“小于”、“等于”)125℃时;为了又快又多地得到产品,乙醇制乙醚合适的反应温度区域是150~175℃.
| A. | 干冰用于人工降雨 | B. | 铁粉用于食品保存 | ||
| C. | 稀有气体用来制作电光源 | D. | 铜用作电线 |


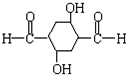 .
.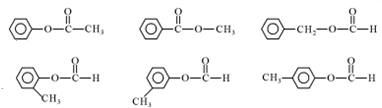 (其中任一种).
(其中任一种).