题目内容
9.A、B、C、D、E五种元素,①它们的质子数依次递增,但都小于18,A元原子核外只有1个电子,B元素原子和C元素原子最外层电子数之差为2,B元素原子最外层上的电子数为次外层电子数的2倍.②1molD元素的单质与足量的盐酸反应有1mol氢气生成,在D和C元素组成的化合物中,D的质量分数为60%.③E的单质为黄绿色气体,其氢化物极易溶于水.(1)画出D原子的结构示意图
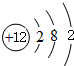 ;画出BC2的电子式
;画出BC2的电子式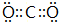 ,结构式O=C=O,其晶体类型为分子晶体
,结构式O=C=O,其晶体类型为分子晶体(2)写出②中反应的化学方程式Mg+2HCl=MgCl2+H2↑
(3)实验室制备E的单质的化学反应方程式MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+2H2O+Cl2↑,将E的单质溶于A2C中呈黄绿色,向其中滴入石蕊试液,现象是溶液先变红后褪色
(4)由D和E形成的化合物.它是由离子键形成的物质,该物质的电子表为
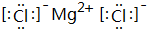 ,其晶体类型为离子晶体.
,其晶体类型为离子晶体.
分析 A、B、C、D、E五种元素,①它们的质子数依次递增,但都小于18,A元原子核外只有1个电子,则A为H元素;B元素原子最外层上的电子数为次外层电子数的2倍,原子只能有2个电子层,最外层电子数为4,故B为碳元素;②1molD元素的单质与足量的盐酸反应有1mol氢气生成,则D表现+2,原子序数大于碳,故D为Mg;由于B元素原子和C元素原子最外层电子数之差为2,C原子最外层电子数为6,C的原子序数小于Mg,故C为O元素,在D和C元素组成的化合物MgO中Mg的质量分数为60%.③E的单质为黄绿色气体,其氢化物极易溶于水,则E为Cl,据此解答.
解答 解:A、B、C、D、E五种元素,①它们的质子数依次递增,但都小于18,A元原子核外只有1个电子,则A为H元素;B元素原子最外层上的电子数为次外层电子数的2倍,原子只能有2个电子层,最外层电子数为4,故B为碳元素;②1molD元素的单质与足量的盐酸反应有1mol氢气生成,则D表现+2,原子序数大于碳,故D为Mg;由于B元素原子和C元素原子最外层电子数之差为2,C原子最外层电子数为6,C的原子序数小于Mg,故C为O元素,在D和C元素组成的化合物MgO中Mg的质量分数为60%.③E的单质为黄绿色气体,其氢化物极易溶于水,则E为Cl.
(1)D为Mg元素,原子的结构示意图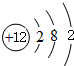 ;CO的电子式为
;CO的电子式为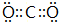 ,结构式为O=C=O,其晶体类型为:分子晶体,
,结构式为O=C=O,其晶体类型为:分子晶体,
故答案为: ;
;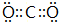 ;O=C=O;分子晶体;
;O=C=O;分子晶体;
(2)②中反应的化学方程式为:Mg+2HCl=MgCl2+H2↑,故答案为:Mg+2HCl=MgCl2+H2↑;
(3)实验室制备氯气的化学反应方程式:MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+2H2O+Cl2↑,将氯气溶于H2O中呈黄绿色,向其中滴入石蕊试液,现象是:溶液先变红后褪色,
故答案为:MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+2H2O+Cl2↑;黄绿;溶液先变红后褪色;
(4)由D和E形成的化合物为MgCl2,它是由离子键形成的物质,该物质的电子式为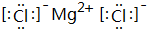 ,其晶体类型为:离子晶体,
,其晶体类型为:离子晶体,
故答案为:离子;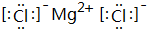 ;离子晶体.
;离子晶体.
点评 本题考查结构性质位置关系应用,推断元素是解题关键,侧重对化学用语的考查,注意对基础知识的理解掌握.

 赢在课堂名师课时计划系列答案
赢在课堂名师课时计划系列答案 天天向上课时同步训练系列答案
天天向上课时同步训练系列答案 阳光课堂同步练习系列答案
阳光课堂同步练习系列答案| A. | 将15.2g CuSO4 溶于水配制成100mL溶液 | |
| B. | 将16.0g CuSO4 溶于水配制成100mL溶液 | |
| C. | 将25.0g 胆矾溶于水配制成100mL溶液 | |
| D. | 将40mL 2.5mol/L CuSO4 溶液用水稀释后配成100mL溶液 |
| A. | 物质的量相同的气体单质具有相同的原子数 | |
| B. | 铁原子的摩尔质量等于它的相对原子质量 | |
| C. | 反应前各反应物的物质的量之和一定等于反应后各生成物的物质的量之和 | |
| D. | 一个氧原子的实际质量等于$\frac{16}{6.02×1{0}^{23}}$g |
| A. | 2NA个H2与NA个O2的质量比为1:8 | |
| B. | 0.5NA个HCl所占的体积约为11.2L | |
| C. | 71gCl2所含的Cl数目为2NA | |
| D. | 1L 0.5mol•L-1FeCl3溶液中含有1.5NA个Cl- |

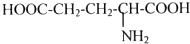 (写结构简式)可以合成二肽(如图2)
(写结构简式)可以合成二肽(如图2)