题目内容
20.某化学实验中需要用到95mL 1.0 mol/L CuSO4 溶液,下列配制方法不正确的是( )| A. | 将15.2g CuSO4 溶于水配制成100mL溶液 | |
| B. | 将16.0g CuSO4 溶于水配制成100mL溶液 | |
| C. | 将25.0g 胆矾溶于水配制成100mL溶液 | |
| D. | 将40mL 2.5mol/L CuSO4 溶液用水稀释后配成100mL溶液 |
分析 由于实验室无95mL容量瓶,故应选择100mL容量瓶,则配制出100mL1.0mol/L的CuSO4 溶液.溶液中含有的CuSO4 的物质的量n=CV=1mol/L×0.1L=0.1mol.
如果用CuSO4来配制,则需要的CuSO4的质量m=nM=0.1mol×160g/mol=16.0g;
如果用胆矾来配制,则需要的胆矾的质量m=nM=0.1mol×250g/mol=25.0g;
如果用2.5mol/L CuSO4 浓溶液来配制,根据溶液的稀释定律来分析所需的2.5mol/L CuSO4 溶液体积.
解答 解:由于实验室无95mL容量瓶,故应选择100mL容量瓶,则配制出100mL1.0mol/L的CuSO4 溶液.溶液中含有的CuSO4 的物质的量n=CV=1mol/L×0.1L=0.1mol.
①如果用CuSO4来配制,则需要的CuSO4的质量m=nM=0.1mol×160g/mol=16.0g,故应将16.0gCuSO4溶于水配制成100mL溶液,故A错误,B正确;
②如果用胆矾来配制,由于1mol胆矾能提供1molCuSO4,则需要的胆矾的物质的量也为0.1mol,则质量m=nM=0.1mol×250g/mol=25.0g,即应将25.0g胆矾溶于水配制成100mL溶液,故C正确;
③如果用2.5mol/L CuSO4 浓溶液来配制,设需要的浓溶液的体积为VmL,根据溶液的稀释定律可知:2.5mol/L×VmL=1.0mol/L×0.1L,解得V=40mL,故需要的2.5mol/L CuSO4 溶液体积为40mL,即将40mL 2.5mol/L CuSO4 溶液用水稀释后配成100mL溶液,则所得溶液的浓度即为1mol/L,故D正确.
故选A.
点评 本题考查了一定物质的量浓度溶液的配制方法,应注意的是胆矾的摩尔质量为250g/mol,难度不大.

| 实验序号 | 甲 | 乙 | 丙 |
| 合金质量/mg | 255 | 385 | 459 |
| 生成气体体积/ml | 280 | 336 | 336 |
(2)选择合适数据,可求得的盐酸物质的量浓度是1mol/L.
(3)选择合适数据,可计算出镁铝的物质的量之比为1:1.
(4)丙组实验后,向容器中加入一定量1.00mol•L-lNaOH溶液,恰好使铝元素全部以A1O2-形式存在,并使Mg2+刚好沉淀完全,则溶液中NaCl的物质的量为0.03mol.
| A. | pH值增大 | B. | 水电离出的c(H+)减小 | ||
| C. | c(OH-)增大 | D. | c(H+)•c(OH-)的值增大 |
| A. | c>d>b>a | B. | b>a>d>c | C. | a>b>c>d | D. | d>c>a>b |
| A. | 50mL 2mol•L-1CaCl2溶液 | B. | 100mL 2mol•L-1NaCl溶液 | ||
| C. | 50mL 4mol•L-1CaCl2溶液 | D. | 100mL 4mol•L-1NaCl溶液 |
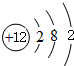 ;画出BC2的电子式
;画出BC2的电子式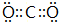 ,结构式O=C=O,其晶体类型为分子晶体
,结构式O=C=O,其晶体类型为分子晶体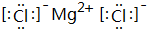 ,其晶体类型为离子晶体.
,其晶体类型为离子晶体. 在273K(即0℃)时,向如图所示的真空密闭容器A中充入0.5g H2时,测得容器内的压强为1.01×105Pa.由此可以判断A容器的体积约为5.6L.若向A中充入的是O2,压强也是1.01×105pa,则充入的O2质量是8g,若向A容器中充入的是C0气体,使容器内压强达到3.03×105Pa.则充入C0气体的质量是21g.
在273K(即0℃)时,向如图所示的真空密闭容器A中充入0.5g H2时,测得容器内的压强为1.01×105Pa.由此可以判断A容器的体积约为5.6L.若向A中充入的是O2,压强也是1.01×105pa,则充入的O2质量是8g,若向A容器中充入的是C0气体,使容器内压强达到3.03×105Pa.则充入C0气体的质量是21g.