题目内容
17.下列说法中,正确的是( )| A. | 物质的量相同的气体单质具有相同的原子数 | |
| B. | 铁原子的摩尔质量等于它的相对原子质量 | |
| C. | 反应前各反应物的物质的量之和一定等于反应后各生成物的物质的量之和 | |
| D. | 一个氧原子的实际质量等于$\frac{16}{6.02×1{0}^{23}}$g |
分析 A.分子可由不同数目的原子构成;
B.摩尔质量在数值上等于相对原子质量;
C.反应前后质量不变,但物质的量不一定相等;
D.根据n=$\frac{m}{M}$=$\frac{N}{{N}_{A}}$计算.
解答 解:A.分子可由不同数目的原子构成,如He和O2,故A错误;
B.摩尔质量在数值上等于相对原子质量,摩尔质量的单位为g/mol,故B错误;
C.反应前后质量不变,但物质的量不一定相等,如N2+3H2=2NH3,故C错误;
D.由n=$\frac{m}{M}$=$\frac{N}{{N}_{A}}$可知个氧原子的实际质量等于$\frac{16}{6.02×1{0}^{23}}$g,故D正确.
故选D.
点评 本题多角度考查物质的量的计算,侧重于基本概念的理解和公式的运用的考查,为高频考点,注意相关计算公式的运用以及物质的构成特点,难度不大.

练习册系列答案
 快乐5加2金卷系列答案
快乐5加2金卷系列答案
相关题目
7.金属汞在加热条件下能和氧气化合生成氧化汞,反应如下:2Hg+O2═2HgO,下列哪个选项可以说明0.4molHg 与 0.4molO2充分反应后物质的种类及其量的情况.( )
| A. | 0.1molHgO与0.3molHg | B. | 0.2molHgO与0.2mol Hg | ||
| C. | 0.4molHgO与0.2mol O2 | D. | 0.4molHgO |
12.下列溶液中Cl-的物质的量浓度与100mL 1mol•L-1 MgCl2溶液中Cl-的物质的量浓度相同的是( )
| A. | 50mL 2mol•L-1CaCl2溶液 | B. | 100mL 2mol•L-1NaCl溶液 | ||
| C. | 50mL 4mol•L-1CaCl2溶液 | D. | 100mL 4mol•L-1NaCl溶液 |
13.某校课外探究小组欲在实验室条件下制取少量纯净的无水氯化铝.查阅到以下资料:无水氯化铝是白色晶体,易吸收水分,常压下在177.8℃升华,遇潮湿空气即产生大量白雾.用于有机合成和石油工业的催化剂,以及用于处理润滑油等.他们设计了以下装置(图1),请结合题意回答问题:
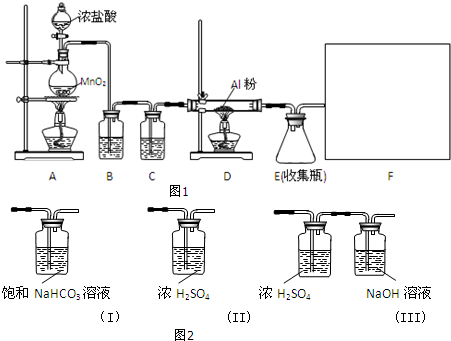
(1)A装置中发生反应的化学方程式为:MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O.
(2)装置B的作用是除去Cl2中混有的HCl气体.
(3)请给标记为F的实线方框选择合适的装置(图2)III.
(4)AlCl3遇潮湿空气即产生大量白雾的原因是AlCl3遇水水解,Al3++3H2O?Al(OH)3+3H+,产生的氯化氢气体在空气中形成酸雾(结合离子方程式说明).
(5)制备反应会因盐酸浓度下降而停止,为测定反应残余液中盐酸的浓度,该小组同学提出酸碱中和滴定法测定方案.方案如下:首先准确量取残余清液稀释一定的倍数后作为试样,平行做了4次滴定.实验中所用NaOH溶液浓度为0.2000mol•L-1,以下是实验记录与数据处理.
①经计算,该次滴定测的试样中盐酸浓度为0.2200mol•L-1
②在本实验的滴定过程中,下列操作会使实验结果偏小的是df(填写序号).
a.开始滴定时滴定管尖嘴处留有气泡,滴定结束气泡消失
b.未用标准NaOH溶液润洗滴定管
c.锥形瓶中加入待测盐酸后,再加少量水
d.锥形瓶在滴定时剧烈摇动.有少量液体溅出
e.滴定前锥形瓶用待测盐酸润洗
f.观察读数时,滴定前仰视,滴定后俯视
(6)工业上常见的制备方法有四种:
a.由金属铝和氯气制取:2Al+3Cl2$\frac{\underline{\;\;△\;\;}}{\;}$2AlCl3
b.由无水氯化氢气体与熔融金属铝制取:2Al+6HCl$\frac{\underline{\;\;△\;\;}}{\;}$2AlCl3+3H2↑
c.用碳氯化法制取:Al2O3+3C+3Cl2 $\frac{\underline{\;\;△\;\;}}{\;}$2AlCl3+3CO
d.用氧化铝和四氯化碳反应制取:Al2O3+3CCl4═2AlCl3+3COCl2↑(光气,一种无色剧毒气体)
则有关以上四种方法的叙述正确的是CD
A.在四个反应中AlCl3均为氧化产物
B.反应b可以改写成离子方程式2Al+6H+═2Al3++3H2↑
C.反应c中每产生2mol AlCl3时转移电子数为6NA(NA代表阿伏加德罗常数的值)
D.反应c、d容易造成大气污染.

(1)A装置中发生反应的化学方程式为:MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O.
(2)装置B的作用是除去Cl2中混有的HCl气体.
(3)请给标记为F的实线方框选择合适的装置(图2)III.
(4)AlCl3遇潮湿空气即产生大量白雾的原因是AlCl3遇水水解,Al3++3H2O?Al(OH)3+3H+,产生的氯化氢气体在空气中形成酸雾(结合离子方程式说明).
(5)制备反应会因盐酸浓度下降而停止,为测定反应残余液中盐酸的浓度,该小组同学提出酸碱中和滴定法测定方案.方案如下:首先准确量取残余清液稀释一定的倍数后作为试样,平行做了4次滴定.实验中所用NaOH溶液浓度为0.2000mol•L-1,以下是实验记录与数据处理.
 | 1 | 2 | 3 | 4 |
| V( 样品 ) | 20.00 | 20.00 | 20.00 | 20.00 |
| V(NaOH)(初读数) | 0.00 | 0.50 | 0.70 | 1.00 |
| V(NaOH)(终读数) | 22.60 | 22.25 | 22.05 | 23.00 |
②在本实验的滴定过程中,下列操作会使实验结果偏小的是df(填写序号).
a.开始滴定时滴定管尖嘴处留有气泡,滴定结束气泡消失
b.未用标准NaOH溶液润洗滴定管
c.锥形瓶中加入待测盐酸后,再加少量水
d.锥形瓶在滴定时剧烈摇动.有少量液体溅出
e.滴定前锥形瓶用待测盐酸润洗
f.观察读数时,滴定前仰视,滴定后俯视
(6)工业上常见的制备方法有四种:
a.由金属铝和氯气制取:2Al+3Cl2$\frac{\underline{\;\;△\;\;}}{\;}$2AlCl3
b.由无水氯化氢气体与熔融金属铝制取:2Al+6HCl$\frac{\underline{\;\;△\;\;}}{\;}$2AlCl3+3H2↑
c.用碳氯化法制取:Al2O3+3C+3Cl2 $\frac{\underline{\;\;△\;\;}}{\;}$2AlCl3+3CO
d.用氧化铝和四氯化碳反应制取:Al2O3+3CCl4═2AlCl3+3COCl2↑(光气,一种无色剧毒气体)
则有关以上四种方法的叙述正确的是CD
A.在四个反应中AlCl3均为氧化产物
B.反应b可以改写成离子方程式2Al+6H+═2Al3++3H2↑
C.反应c中每产生2mol AlCl3时转移电子数为6NA(NA代表阿伏加德罗常数的值)
D.反应c、d容易造成大气污染.
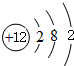 ;画出BC2的电子式
;画出BC2的电子式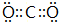 ,结构式O=C=O,其晶体类型为分子晶体
,结构式O=C=O,其晶体类型为分子晶体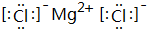 ,其晶体类型为离子晶体.
,其晶体类型为离子晶体.