题目内容
11.对于放热反应H2+Cl2$\frac{\underline{\;点燃\;}}{\;}$2HCl,下列说法正确的是( )| A. | 该反应涉及到离子键和共价键的断裂与形成 | |
| B. | 该反应中,化学能只转变为热能 | |
| C. | 断开1molH-H键和1molCl-Cl键所吸收的总能量,小于形成1molH-Cl键所放出的能量 | |
| D. | 反应物所具有的总能量高于产物所具有的总能量 |
分析 A.根据活泼金属和活泼非金属之间易形成离子键,非金属元素之间易形成共价键(铵盐除外);
B.根据放热反应中化学能转变为热能、光能等;
C.根据放热反应的本质是生成物成键释放的总能量大于反应物断键吸收的总能量;
D.根据放热反应中反应物所具有的总能量高于产物所具有的总能量.
解答 解:A.该反应只涉及到了共价键的断裂与形成,没有离子键的断裂与形成,故A错误;
B.放热反应中化学能转变为热能、光能等,不是只转变为热能,故B错误;
C.H2+Cl2$\frac{\underline{\;点燃\;}}{\;}$2HCl是放热反应,断开1mol H-H键和1mol Cl-Cl键,所吸收的总能量,小于形成2mol H-Cl键,所放出的能量,故C错误;
D.H2+Cl2$\frac{\underline{\;点燃\;}}{\;}$2HCl是放热反应,所以反应物所具有的总能量高于产物所具有的总能量,故D正确.
故选D.
点评 本题主要考查了化学反应的本质以及能量变化的宏观和微观原因,难度不大,注意基础知识的积累.

练习册系列答案
相关题目
2.2015年6月5日是世界环境日,今年的主题是“践行绿色生活,”下列有关说法中错误的是( )
| A. | 煤的气化、液化是使煤变成清洁能源,减少环境污染的有效途径 | |
| B. | 高纯硅可制作太阳能电池,二氧化硅可制作光导纤维 | |
| C. | 利用工业生产产生的二氧化碳制造全降解塑料,可以缓解温室效应 | |
| D. | 棉、麻、羊毛及合成纤维完全燃烧都只生成CO2和H2O |
19.用惰性电极电解下列溶液的说法正确是( )
| A. | 电解氯化钾溶液的过程中,溶液的pH变小 | |
| B. | 电解硝酸银溶液的过程中,阴极质量不变,阳极质量增大 | |
| C. | 电解硫酸钠溶液的过程中,两极产生气体的物质的量不相同 | |
| D. | 电解氢氧化钠溶液的过程中,氢氧化钠的物质的量浓度减小 |
6.下列使用仪器或用品的操作错误的是( )
| A. | 使用石蕊试纸检验气体需要现用蒸馏水湿润 | |
| B. | 使用容量瓶要先检查是否漏水 | |
| C. | 使用锥形瓶进行酸碱中和滴定要先用待测液润洗 | |
| D. | 使用棕色瓶保存浓硝酸 |
16.下列物质不能使酸性KMnO4溶液褪色的是( )
| A. |  | B. | C2H2 | C. |  | D. | 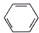 |
3.下列实验及现象所对应的离子方程式正确的是( )
| 选项 | 实验 | 现象 | 离子方程式 |
| A | 向氯化铝溶液中滴加过量氨水 | 有白色沉淀产生 | Al3++3OH-=Al(OH)3↓ |
| B | 向FeBr2溶液中通入少量氯气 | 溶液由浅绿色变成黄色 | 2Fe2++Cl2=2Fe3++2Cl- |
| C | 向稀硝酸中加入单质Fe粉 | 有气泡生成 | Fe+6H+=3Fe3++3H2↑ |
| D | 向Na2CO3溶液中滴加酚酞试剂 | 溶液由无色变为红色 | CO32-+H2O=H2CO3+2OH- |
| A. | A | B. | B | C. | C | D. | D |
1.下列金属治炼的反应原理,错误的是( )
| A. | 2NaCl(熔融)$\frac{\underline{\;电解\;}}{\;}$2Na+Cl2↑ | B. | 2HgO$\frac{\underline{\;\;△\;\;}}{\;}$2Hg+O2↑ | ||
| C. | Fe3O4+3CO$\frac{\underline{\;高温\;}}{\;}$3Fe+3CO2 | D. | MgO+H2$\frac{\underline{\;\;△\;\;}}{\;}$Mg+H2O |
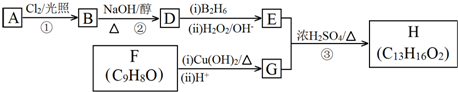
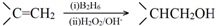
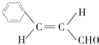 .
.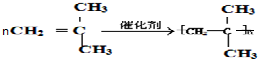 .
.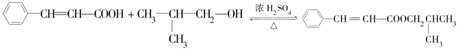 .
. .
. ,形成该化合物的化学键有离子键和共价键
,形成该化合物的化学键有离子键和共价键