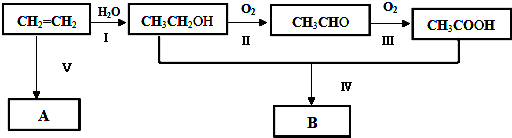
题目内容
19.用惰性电极电解下列溶液的说法正确是( )| A. | 电解氯化钾溶液的过程中,溶液的pH变小 | |
| B. | 电解硝酸银溶液的过程中,阴极质量不变,阳极质量增大 | |
| C. | 电解硫酸钠溶液的过程中,两极产生气体的物质的量不相同 | |
| D. | 电解氢氧化钠溶液的过程中,氢氧化钠的物质的量浓度减小 |
分析 A、电解氯化钾溶液,生成氢氧化钾和氢气、氯气;
B、电解硝酸银溶液,在阴极上和阳极上析出产物分别是金属银和氧气;
C、电解硫酸钠溶液,实质电解水,阳极生成氧气,阴极生成氢气;
D、电解稀氢氧化钠溶液,实质上是电解水,氢氧化钠溶液的浓度变大.
解答 解:A、电解氯化钾溶液,要消耗H+,生成KOH,故溶液pH增大,故A错误;
B、电解硝酸银溶液,在阴极上和阳极上析出产物分别是金属银和氧气,所以阴极质量增大,阳极质量不变,故B错误;
C、电解硫酸钠溶液,实质电解水,阳极生成氧气,阴极生成氢气,则阴极和阳极析出产物的物质的量之比为2:1,故C正确;
D、电解稀氢氧化钠溶液,实质是电解水,氢氧化钠溶液的浓度变大,故D错误.
故选C.
点评 本题考查学生电解池的工作原理知识,注意离子的放电顺序是关键,难度不大.

练习册系列答案
相关题目
9.在下列各指定溶液中,离子可能大量共存的是( )
| A. | 澄清透明的溶液中:Cu2+、Fe3+、NO3-、Cl- | |
| B. | 使pH试纸变蓝的溶液中:NH4+、Na+、SO42-、Cl- | |
| C. | 含有大量ClO-的溶液中:K+、OH-、I-、SO32- | |
| D. | c(Fe3+)=0.1mol•L-1的溶液中:K+、ClO-、SO42-、SCN- |
10.下表是元素周期表的一部分,针对表中的①~⑦种元素,填写下列空白:
(1)在这些元素中,(用元素符号填写,下同)金属性最强的元素是Na;非金属性最强的是Cl;最不活泼的元素是Ar.
(2)这些元素的最高价氧化物的对应水化物中,酸性最强的化合物的分子式是HClO4;碱性最强的化合物的电子式是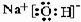 ;能形成两性氢氧化物的元素是Al.
;能形成两性氢氧化物的元素是Al.
(3)②的氢化物分子式为NH3,属于共价化合物(填“共价”或“离子”);
(4)⑤元素的原子结构示意图为 .
.
| 主族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0族 |
| 2 | ① | ② | ||||||
| 3 | ③ | ④ | ⑤ | ⑥ | ⑦ |
(2)这些元素的最高价氧化物的对应水化物中,酸性最强的化合物的分子式是HClO4;碱性最强的化合物的电子式是
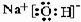 ;能形成两性氢氧化物的元素是Al.
;能形成两性氢氧化物的元素是Al.(3)②的氢化物分子式为NH3,属于共价化合物(填“共价”或“离子”);
(4)⑤元素的原子结构示意图为
 .
.
7.下列各组物质中,互为同系物的是( )
| A. | CH4和CH3CH2CH3 | B. | ${\;}_{17}^{35}$Cl和${\;}_{17}^{37}$Cl | ||
| C. | 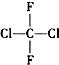 和 和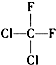 | D. |  和CH3-CH2-CH2-CH3 和CH3-CH2-CH2-CH3 |
11.对于放热反应H2+Cl2$\frac{\underline{\;点燃\;}}{\;}$2HCl,下列说法正确的是( )
| A. | 该反应涉及到离子键和共价键的断裂与形成 | |
| B. | 该反应中,化学能只转变为热能 | |
| C. | 断开1molH-H键和1molCl-Cl键所吸收的总能量,小于形成1molH-Cl键所放出的能量 | |
| D. | 反应物所具有的总能量高于产物所具有的总能量 |
8.贵州开磷(集团)有限责任公司按照循环经济的发展理念,将工业合成氨与制备甲醇进行联合生产,现已具备年产60万吨合成氨、38万吨甲醇的生产能力.其生产流程如图1:
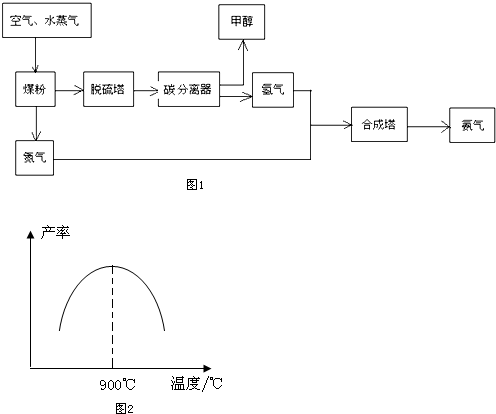
请回答下列问题:
(1)工业生产时,水蒸气可与煤粉反应制备H2,反应的化学方程式为C+H2O(g)$\frac{\underline{\;高温\;}}{\;}$CO+H2;
(2)工业制取氢气的另一个反应为:CO+H2O(g)?CO2+H2.在T℃时,往1L密闭容器中充入0.2molCO和0.3mol水蒸气,反应达平衡后,体系中c(H2)═0.12mol•L-1.该温度下此反应的平衡常数K=1(填计算结果);
(3)若在恒温恒容的容器内进行反应CO(g)+2H2 (g)?C H3OH(g),在密闭容器中开始只加入CO、H2,反应10min后测得各组分的浓度如下:
①该时间段内反应速率v(H2)=0.08mol/(L•min);
②该反应达到平衡状态的标志是BC(填字母序号);
A.有1个H-H键生成的同时有3个C-H键生成
B.CO的百分含量保持不变
C.容器中混合气体的压强不变化
D.容器中混合气体的密度不变化
(4)已知在常温常压下:
①2C H3OH(l)+3O2 (g)?2CO2 (g)+4H2 O(g)△H1=-1275.6kJ/mol
②2C O(l)+O2 (g)?2CO2 (g)△H2=-566.0kJ/mol
③H2O (g)?H2 O(l)△H3=-44.0kJ/mol
写出甲醇不完燃烧生成一氧化碳和液态水的热化学方程式CH3OH(l)+O2(g)=CO(g)+2H2O(l)△H=-442.8kJ•mol-1;
(5)N2和H2以铁作催化剂从145℃就开始反应,不同温度下NH3的产率如图2所示.温度高于900℃时,NH3产率下降的原因是温度高于900℃时,平衡向左移动;生产过程中合成气要进行循环,其目的是提高原料的利用率.

请回答下列问题:
(1)工业生产时,水蒸气可与煤粉反应制备H2,反应的化学方程式为C+H2O(g)$\frac{\underline{\;高温\;}}{\;}$CO+H2;
(2)工业制取氢气的另一个反应为:CO+H2O(g)?CO2+H2.在T℃时,往1L密闭容器中充入0.2molCO和0.3mol水蒸气,反应达平衡后,体系中c(H2)═0.12mol•L-1.该温度下此反应的平衡常数K=1(填计算结果);
(3)若在恒温恒容的容器内进行反应CO(g)+2H2 (g)?C H3OH(g),在密闭容器中开始只加入CO、H2,反应10min后测得各组分的浓度如下:
| 物质 | H2 | CO | C H3OH |
| 浓度/(mol•L-1) | 0.20 | o.10 | o.40 |
②该反应达到平衡状态的标志是BC(填字母序号);
A.有1个H-H键生成的同时有3个C-H键生成
B.CO的百分含量保持不变
C.容器中混合气体的压强不变化
D.容器中混合气体的密度不变化
(4)已知在常温常压下:
①2C H3OH(l)+3O2 (g)?2CO2 (g)+4H2 O(g)△H1=-1275.6kJ/mol
②2C O(l)+O2 (g)?2CO2 (g)△H2=-566.0kJ/mol
③H2O (g)?H2 O(l)△H3=-44.0kJ/mol
写出甲醇不完燃烧生成一氧化碳和液态水的热化学方程式CH3OH(l)+O2(g)=CO(g)+2H2O(l)△H=-442.8kJ•mol-1;
(5)N2和H2以铁作催化剂从145℃就开始反应,不同温度下NH3的产率如图2所示.温度高于900℃时,NH3产率下降的原因是温度高于900℃时,平衡向左移动;生产过程中合成气要进行循环,其目的是提高原料的利用率.
9.下列化合物中同分异构体数目最多的是( )
| A. | 戊烷 | B. | 戊烯 | C. | 戊醇 | D. | 戊酸 |