题目内容
16.下列物质不能使酸性KMnO4溶液褪色的是( )| A. |  | B. | C2H2 | C. |  | D. | 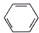 |
分析 含有不饱和键的有机物以及乙醇等可与酸性高锰酸钾发生氧化还原反应,以此解答.
解答 解:A、 为2-甲基-1-丙烯,含有不饱和键,能与酸性高锰酸钾发生氧化还原反应,能使酸性KMnO4溶液褪色,故A不选;
为2-甲基-1-丙烯,含有不饱和键,能与酸性高锰酸钾发生氧化还原反应,能使酸性KMnO4溶液褪色,故A不选;
B、C2H2为乙炔,含有不饱和键,能与酸性高锰酸钾发生氧化还原反应,能使酸性KMnO4溶液褪色,故B不选;
C、苯的同系物可以使高锰酸钾溶液褪色,故C不选;
D、苯与酸性高锰酸钾不反应,则不能使酸性KMnO4溶液褪色的是苯,故D选;故选D.
点评 本题综合考查有机物的性质,注意把握有机物的结构和官能团的性质,为解答该题的关键,难度不大.

练习册系列答案
相关题目
7.下列各组物质中,互为同系物的是( )
| A. | CH4和CH3CH2CH3 | B. | ${\;}_{17}^{35}$Cl和${\;}_{17}^{37}$Cl | ||
| C. | 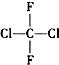 和 和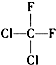 | D. |  和CH3-CH2-CH2-CH3 和CH3-CH2-CH2-CH3 |
11.对于放热反应H2+Cl2$\frac{\underline{\;点燃\;}}{\;}$2HCl,下列说法正确的是( )
| A. | 该反应涉及到离子键和共价键的断裂与形成 | |
| B. | 该反应中,化学能只转变为热能 | |
| C. | 断开1molH-H键和1molCl-Cl键所吸收的总能量,小于形成1molH-Cl键所放出的能量 | |
| D. | 反应物所具有的总能量高于产物所具有的总能量 |
1.2014年在西非国家爆发的埃博拉疫情呈加速蔓延之势,已知该病毒对化学药品敏感,乙醇、高锰酸钾溶液、次氯酸钠溶液、双氧水等消毒剂可以完全灭活病毒感染性.下列有关说法正确的是( )
| A. | 乙醇、次氯酸钠溶液的消毒原理相同 | |
| B. | 双氧水和次氯酸钠具有较强的腐蚀性,不能用于皮肤的消毒 | |
| C. | 高锰酸钾溶液和双氧水均可以将病毒氧化而达到消毒的目的 | |
| D. | 在次氯酸钠溶液中通入少量二氧化硫可发生反应:2NaClO+SO2+H2O═Na2SO3+HClO |
8.贵州开磷(集团)有限责任公司按照循环经济的发展理念,将工业合成氨与制备甲醇进行联合生产,现已具备年产60万吨合成氨、38万吨甲醇的生产能力.其生产流程如图1:
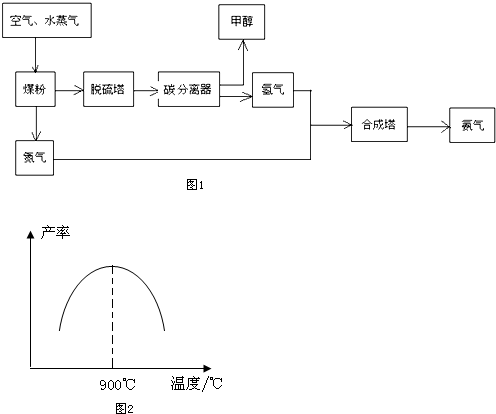
请回答下列问题:
(1)工业生产时,水蒸气可与煤粉反应制备H2,反应的化学方程式为C+H2O(g)$\frac{\underline{\;高温\;}}{\;}$CO+H2;
(2)工业制取氢气的另一个反应为:CO+H2O(g)?CO2+H2.在T℃时,往1L密闭容器中充入0.2molCO和0.3mol水蒸气,反应达平衡后,体系中c(H2)═0.12mol•L-1.该温度下此反应的平衡常数K=1(填计算结果);
(3)若在恒温恒容的容器内进行反应CO(g)+2H2 (g)?C H3OH(g),在密闭容器中开始只加入CO、H2,反应10min后测得各组分的浓度如下:
①该时间段内反应速率v(H2)=0.08mol/(L•min);
②该反应达到平衡状态的标志是BC(填字母序号);
A.有1个H-H键生成的同时有3个C-H键生成
B.CO的百分含量保持不变
C.容器中混合气体的压强不变化
D.容器中混合气体的密度不变化
(4)已知在常温常压下:
①2C H3OH(l)+3O2 (g)?2CO2 (g)+4H2 O(g)△H1=-1275.6kJ/mol
②2C O(l)+O2 (g)?2CO2 (g)△H2=-566.0kJ/mol
③H2O (g)?H2 O(l)△H3=-44.0kJ/mol
写出甲醇不完燃烧生成一氧化碳和液态水的热化学方程式CH3OH(l)+O2(g)=CO(g)+2H2O(l)△H=-442.8kJ•mol-1;
(5)N2和H2以铁作催化剂从145℃就开始反应,不同温度下NH3的产率如图2所示.温度高于900℃时,NH3产率下降的原因是温度高于900℃时,平衡向左移动;生产过程中合成气要进行循环,其目的是提高原料的利用率.

请回答下列问题:
(1)工业生产时,水蒸气可与煤粉反应制备H2,反应的化学方程式为C+H2O(g)$\frac{\underline{\;高温\;}}{\;}$CO+H2;
(2)工业制取氢气的另一个反应为:CO+H2O(g)?CO2+H2.在T℃时,往1L密闭容器中充入0.2molCO和0.3mol水蒸气,反应达平衡后,体系中c(H2)═0.12mol•L-1.该温度下此反应的平衡常数K=1(填计算结果);
(3)若在恒温恒容的容器内进行反应CO(g)+2H2 (g)?C H3OH(g),在密闭容器中开始只加入CO、H2,反应10min后测得各组分的浓度如下:
| 物质 | H2 | CO | C H3OH |
| 浓度/(mol•L-1) | 0.20 | o.10 | o.40 |
②该反应达到平衡状态的标志是BC(填字母序号);
A.有1个H-H键生成的同时有3个C-H键生成
B.CO的百分含量保持不变
C.容器中混合气体的压强不变化
D.容器中混合气体的密度不变化
(4)已知在常温常压下:
①2C H3OH(l)+3O2 (g)?2CO2 (g)+4H2 O(g)△H1=-1275.6kJ/mol
②2C O(l)+O2 (g)?2CO2 (g)△H2=-566.0kJ/mol
③H2O (g)?H2 O(l)△H3=-44.0kJ/mol
写出甲醇不完燃烧生成一氧化碳和液态水的热化学方程式CH3OH(l)+O2(g)=CO(g)+2H2O(l)△H=-442.8kJ•mol-1;
(5)N2和H2以铁作催化剂从145℃就开始反应,不同温度下NH3的产率如图2所示.温度高于900℃时,NH3产率下降的原因是温度高于900℃时,平衡向左移动;生产过程中合成气要进行循环,其目的是提高原料的利用率.
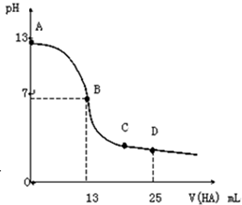 常温下,向25mL0.1mol•L-1MOH溶液中逐滴加入0.2mol•L-1HA溶液,曲线如图所示(体积变化忽略不计).回答下列问题:
常温下,向25mL0.1mol•L-1MOH溶液中逐滴加入0.2mol•L-1HA溶液,曲线如图所示(体积变化忽略不计).回答下列问题: