��Ŀ����
����Ŀ���廯��ͭ�����ڲ�ɫ���࣬��һ�ְ�ɫ�ᾧ״��ĩ������ֽ⣬�ڿ����л�������������ɫ�����������ᡢ���ᡢ����Ͱ�ˮ������ˮ��Ҳ�ᷢ���ֽ⡣ʵ�����Ʊ�CuBr��װ��ʾ��ͼ�Ͳ������£�
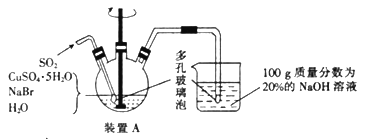
ʵ�鲽�裺
����װ��A�м���50.0 g CuSO4o5H2O��30.9 g NaBr��150 mL����ˮ��60��ʱ���Ͻ��裬���ʵ�����ͨ��SO2��
����Һ��ȴ����ȥ�ϲ���Һ���ڱܹ�������¹��ˣ�
����������������SO2��ˮ����������SO2���Ҵ���������ϴ�ӣ�
����˫����������ֱ�װ��Ũ������������ƣ��и���34h,�پ������������������ո���õ���Ʒ21.6 g��
�ش��������⣺
��1��������й�����Ҫ�ܹ��ԭ����________________________________________________��
��2���������ʵ����������ˮ����Ҫ���еĴ���������_______________�����Ʒ�Ӧ��60�������½��У�ʵ���пɲ�ȡ�Ĵ�ʩ��________________________��
��3���������ϴ�Ӽ��衰����SO2����ԭ����__________________________________�����ϴ�Ӽ��������ѵ�Ŀ����_____________________________________��
��4��װ��A�з�Ӧ����CuBr�����ӷ���ʽΪ__________________________��˵����Ӧ����ɵ�������_____________________________________________________��
��5����ʵ���Ʒ�IJ�����_____________________��
���𰸡� ��ֹCuBr����ֽ� ������� 60��ˮԡ���� ��ֹCuBr������ ��ȥ�����Ҵ�����ʹ������ٸ��� 2Cu2++2Br-+SO2+ 2H2O=2CuBr��+SO42-+4H+ ��Һ��ɫ��ȫ��ȥ 75.0%
��������(1)�廯��ͭ�����ֽ⣬���Բ���2������Ҫ�ܹ⣬��ֹCuBr����ֽ⣻
(2)�廯��ͭ�ܱ����������������ö�������ԭͭ���������廯��ͭҪ�ų������ĸ��ţ�����ͨ��������еķ�����ȥ����ˮ�е�O2�����Ʒ�Ӧ��60����У�������60���ˮԡ������
(3)�ڿ����л�����������������ϴ�Ӽ���������SO2�����Է�ֹCuBr������������ܼ��������ѿ��Գ�ȥ�����Ҵ�����ʹ������ٸ��
(4)������ƿ��ͭ���ӱ���������ԭ����ͭ���ӣ��������ӷ�Ӧ����CuBr��������Ӧ�����ӷ���ʽΪ2Cu2++2Br-+SO2+2H2O=2CuBr��+SO42-+4H+������Һ��ɫ��ȫ��ȥ��˵����Ӧ�������
(5)50.0 g CuSO4��5H2O�����ʵ���Ϊ0.2mol����������CuBr�����ʵ���Ϊ0.2mol������Ϊ0.2mol��144g/mol=28.8g����ʵ���Ʒ�IJ�����![]() ��100%=75.0%��
��100%=75.0%��

 ��ʦ����ָ���ο�ʱϵ�д�
��ʦ����ָ���ο�ʱϵ�д�����Ŀ��ʵ�����Ʊ�1��2����������ķ�Ӧԭ��������ʾ��
��һ����CH3CH2OH ![]() CH2=CH2��H2O��
CH2=CH2��H2O��
�ڶ�������ϩ����ˮ��Ӧ�õ�1��2���������顣
���ܴ��ڵ���Ҫ����Ӧ�У��Ҵ���Ũ����Ĵ�������140 ������ˮ��������(CH3CH2OCH2CH3)��������������������Ҵ��Ʊ�1��2�����������װ����ͼ��ʾ(����װ��δ����)��
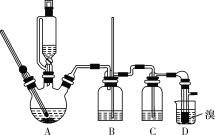
�й������б����£�
�Ҵ� | 1��2���������� | ���� | |
״̬ | ��ɫҺ�� | ��ɫҺ�� | ��ɫҺ�� |
�ܶ�/(g/cm3) | 0.79 | 2.2 | 0.71 |
�е�/(��) | 78.5 | 132 | 34.6 |
�۵�/(��) | ��130 | 9 | ��116 |
��ش��������⣺
(1)д����ϩ����ˮ��Ӧ�Ļ�ѧ����ʽ��___________________________________��
(2)�ڴ��Ʊ�ʵ���У�Ҫ������Ѹ�ٵذѷ�Ӧ�¶���ߵ�170 �����ң�������ҪĿ����___________(����ĸ����)��
a��������Ӧ��������������b���ӿ췴Ӧ����
c����ֹ�Ҵ��ӷ� d�����ٸ�������������
(3)װ��B��������__________________��
(4)��װ��C��Ӧ����_________(����ĸ����)����Ŀ�������շ�Ӧ�п������ɵ�SO2��CO2���塣
a��ˮ��������������������b��Ũ����
c������������Һ d������̼��������Һ
(5)��1��2����������ֲ�Ʒ���ڷ�Һ©���м�ˮ�����ã�����Ӧ��__________(����������������)�㡣
(6)��������������δ��Ӧ��Br2�������________(����ĸ����)ϴ�ӳ�ȥ��
a��ˮ������b������������Һ������c���⻯����Һ������d���Ҵ�
(7)�����������������������ѣ�����__________�ķ�����ȥ��
(8)�жϸ��Ʊ���Ӧ�Ѿ��������������___________________________��