题目内容
【题目】实验室制备1,2-二溴乙烷的反应原理如下所示:
第一步:CH3CH2OH ![]() CH2=CH2+H2O;
CH2=CH2+H2O;
第二步:乙烯与溴水反应得到1,2-二溴乙烷。
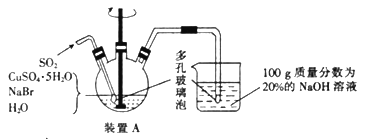
可能存在的主要副反应有:乙醇在浓硫酸的存在下在140 ℃下脱水生成乙醚(CH3CH2OCH2CH3)。用少量的溴和足量的乙醇制备1,2-二溴乙烷的装置如图所示(部分装置未画出):
有关数据列表如下:
乙醇 | 1,2-二溴乙烷 | 乙醚 | |
状态 | 无色液体 | 无色液体 | 无色液体 |
密度/(g/cm3) | 0.79 | 2.2 | 0.71 |
沸点/(℃) | 78.5 | 132 | 34.6 |
熔点/(℃) | -130 | 9 | -116 |
请回答下列问题:
(1)写出乙烯与溴水反应的化学方程式:___________________________________。
(2)在此制备实验中,要尽可能迅速地把反应温度提高到170 ℃左右,其最主要目的是___________(填字母代号)。
a.引发反应 b.加快反应速率
c.防止乙醇挥发 d.减少副产物乙醚生成
(3)装置B的作用是__________________。
(4)在装置C中应加入_________(填字母代号),其目的是吸收反应中可能生成的SO2、CO2气体。
a.水 b.浓硫酸
c.氢氧化钠溶液 d.饱和碳酸氢钠溶液
(5)将1,2-二溴乙烷粗产品置于分液漏斗中加水,振荡后静置,产物应在__________(填“上”或“下”)层。
(6)若产物中有少量未反应的Br2,最好用________(填字母代号)洗涤除去。
a.水 b.氢氧化钠溶液 c.碘化钠溶液 d.乙醇
(7)若产物中有少量副产物乙醚,可用__________的方法除去。
(8)判断该制备反应已经结束的最简单方法是___________________________。
【答案】 CH2=CH2+Br2―→CH2BrCH2Br d 安全瓶的作用 c 下 b 蒸馏 溴的颜色完全褪去
【解析】(1)根据乙烯的加成反应书写;
(2)根据乙醇在浓硫酸做催化剂、脱水剂条件下加热到140度发生副反应生成乙醚分析解答;
(3)从防止气体压强突然增大角度分析解答;
(4)根据二氧化硫、二氧化碳的性质分析解答;
(5)根据1,2-二溴乙烷密度大于水,不溶于水分析解答;
(6)根据溴的性质类似与氯气,分析解答;
(7)依据乙醚与1,2-二溴乙互溶,二者熔沸点不同选择分离方法;
(8)根据溴水为橙黄色,如果完全反应,则D溶液中不存在溴分析解答。
(1)乙烯与溴水发生加成反应,反应的化学方程式为CH2=CH2+Br2→CH2BrCH2Br,故答案为:CH2=CH2+Br2→CH2BrCH2Br;
(2)乙醇在浓硫酸做催化剂、脱水剂条件下加热到140度发生副反应生成乙醚,所以要制备乙烯应尽可能快地把反应温度提高到170℃,减少副产物乙醚的生成,故答案为:d;
(3)装置B的长玻璃管可以平衡装置中的压强,起安全瓶的作用,故答案为:安全瓶;
(4)浓硫酸具有脱水性,强氧化性,能够与乙醇脱水生成的碳发生氧化还原反应生成二氧化硫、二氧化碳气体,二者为酸性氧化物能够与碱液反应,为除去乙烯中的二氧化硫、二氧化碳气,应选择碱性溶液;a.二氧化碳水溶性较小,吸收不充分,故a不选;b.二氧化碳、二氧化硫与浓硫酸不反应,不能用浓硫酸吸收,故b不选;c.二氧化硫、二氧化碳气为酸性氧化物,能够与氢氧化钠溶液反应而被吸收,故c选;d.碳酸氢钠不能吸收二氧化碳,故d不选;故选:c;
(5)1,2-二溴乙烷密度大于水,不溶于水,所以:将1,2-二溴乙烷粗产品置于分液漏斗中加水,振荡后静置,产物应在下层;故答案为:下;
(6)a.溴更易溶于1,2-二溴乙烷,用水无法除去溴,故a不选;b.常温下Br2和氢氧化钠发生反应:2NaOH+Br2═NaBr+NaBrO+H2O,再分液除去,但1,2-二溴乙烷在氢氧化钠水溶液、加热条件下容易发生水解反应,低温下,可用氢氧化钠出去溴杂质,故b选;c.NaI与溴反应生成碘,碘与1,2-二溴乙烷互溶,不能分离,故c不选;d.酒精与1,2-二溴乙烷互溶,不能除去混有的溴,故d不选;故选b;
(7)乙醚与1,2-二溴乙互溶,二者熔沸点不同选择,应用蒸馏的方法分离二者;故答案为:蒸馏;
(8)溴水为橙黄色,如果完全反应生成的1,2-二溴乙烷无色,所以可以通过观察D中溴水是否完全褪色判断制备反应已经结束;故答案为:D中溴水完全褪色。

 名校课堂系列答案
名校课堂系列答案