题目内容
【题目】某校化学兴趣小组欲制取SO2,并探究SO2与FeCl3溶液的反应。在图中选用必要装置完成实验。
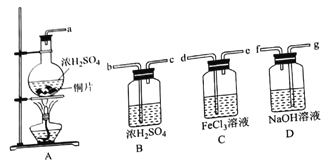
(1)所选装置按气流方向的连接顺序为_________(填仪器接口的字母编号)。
(2)装置A中盛放浓硫酸和铜片的仪器名称为________,发生反应的化学方程式为______。
(3)欲配制装置C中100mL1mol/LFeCl3溶液,需要用到的玻璃仪器除烧杯、玻璃棒、量筒外,还需要_______;所配溶液需用盐酸酸化,请结合离子方程式解释原因: _______ 。
(4)实验过程中观察到装置C中的实验现象为溶液由棕黄色变成红棕色,最终变成浅绿色。甲同学认为红棕色的出现,可能是产生了Fe(OH)3胶体,再混合其他颜色导致;乙同学查阅资料发现Fe(HSO3)2+为红棕色,且具有较强的还原性,认为红棕色是Fe(HSO3)2+所引起。你认为____(填“甲”或“乙”)同学分析较为合理,原因为__________,验证两位同学结论的方法为____________。
【答案】 adeg 圆底烧瓶 Cu+2H2SO4(浓)![]() CuSO4+SO2↑+2H2O 胶头滴管 100ml容量瓶 Fe3++3H2O
CuSO4+SO2↑+2H2O 胶头滴管 100ml容量瓶 Fe3++3H2O![]() Fe(OH)3+3H+,盐酸可抑制Fe3+水解 乙 实验过程中并未促进Fe3+水解 丁达尔效应
Fe(OH)3+3H+,盐酸可抑制Fe3+水解 乙 实验过程中并未促进Fe3+水解 丁达尔效应
【解析】(1)按照气体制备、性质探究和尾气处理连接即可。没有必要除去水蒸气,所以连接顺序为adeg。
(2)装置A中盛放浓硫酸和铜片的仪器名称为圆底烧瓶,发生反应的化学方程式为Cu+2H2SO4(浓)![]() CuSO4+SO2↑+2H2O。
CuSO4+SO2↑+2H2O。
(3)配置溶液需要用到的玻璃仪器除烧杯、玻璃棒、量筒外,还需要胶头滴管、100mL容量瓶;所配置溶液需用盐酸酸化的原因为抑制Fe3+的水解:Fe3++3H2O![]() Fe(OH)3+3H+。
Fe(OH)3+3H+。
(4)乙同学分析的较为合理,原因为反应中溶液为酸性,Fe3+水解程度较小,不具备生成Fe(OH)3胶体的条件,验证两同学结论的方法为丁达尔效应。

 暑假衔接培优教材浙江工商大学出版社系列答案
暑假衔接培优教材浙江工商大学出版社系列答案 欣语文化快乐暑假沈阳出版社系列答案
欣语文化快乐暑假沈阳出版社系列答案