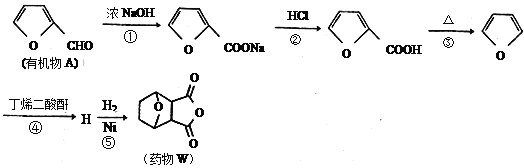
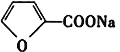
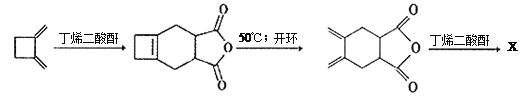
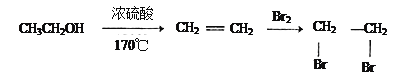题目内容
【题目】请根据物质在生产、生活等方面的应用填空。
(1)厨房里常使用小苏打,向其水溶液中滴加酚酞溶液后,溶液呈__________(填字母代号)。
a.浅蓝色 b.浅红色 c.浅绿色
(2)检验某补铁剂中的Fe2+是否被氧化成Fe3+,可用__________溶液(填字母代号)。
a.NaOH b.H2O2 c.KSCN
(3)电解氧化铝时加入冰晶石的作用为________________。
(4)完成乙醇发生催化氧化的化学方程式:2CH3CH2OH+O2![]() _________________________。
_________________________。
(5)常见的酸性锌锰电池的负极材料为Zn,请写出负极的电极反应式:___________________。
(6)铝热反应是工业上常用的反应之一,请写出Al与Fe3O4发生铝热反应的化学方程式:___________。
【答案】bc降低氧化铝的熔点2CH3CHO+2H2OZn-2e-=Zn2+8Al+3Fe3O4![]() 4Al2O3+9Fe
4Al2O3+9Fe
【解析】
(1)根据小苏打的主要成分为碳酸氢钠,在溶液中水解程度大于电离程度分析判断;
(2)根据检验是否含有Fe3+的方法分析判断;
(3)根据氧化铝的熔点很高,熔融需要消耗大量能源分析判断;
(4)根据伯醇可以被催化氧化生成醛和水分析解答;
(5)根据负极发生氧化反应,分析解答;
(6)Al与Fe3O4反应生成Fe和Al2O3 分析书写。
(1)厨房里常使用小苏打,碳酸氢钠水解程度大于电离程度,溶液显碱性,向其水溶液中滴加酚酞溶液后,溶液呈浅红色,故选b;
(2)检验某补铁剂中的Fe2+是否被氧化成Fe3+,只需要检验是否含有Fe3+即可,故选c;
(3)电解氧化铝时加入冰晶石可以降低氧化铝的熔点,故答案为:降低氧化铝的熔点;
(4)乙醇在通作催化剂时,可以被氧气氧化为乙醛,反应的方程式为:2CH3CH2OH+O2![]() 2CH3CHO+2H2O,故答案为:2CH3CHO+2H2O;
2CH3CHO+2H2O,故答案为:2CH3CHO+2H2O;
(5)常见的酸性锌锰电池的负极材料为Zn,负极发生氧化反应,电极反应式为Zn-2e-===Zn2+,故答案为:Zn-2e-===Zn2+;
(6)Al与Fe3O4发生铝热反应的化学方程式8Al+3Fe3O4 =9Fe+4Al2O3,故答案为:8Al+3Fe3O4 =9Fe+4Al2O3 。

 开心快乐假期作业暑假作业西安出版社系列答案
开心快乐假期作业暑假作业西安出版社系列答案 名题训练系列答案
名题训练系列答案 期末集结号系列答案
期末集结号系列答案