题目内容
11. 氮是地球上极为丰富的元素.
氮是地球上极为丰富的元素.(1)Li3N晶体中氮以N3-存在,基态N3-的电子排布式为1s22s22p6.
(2)根据等电子原理,CO与N2互为等电子体,请写出CO分子结构式C≡O.
(3)在极性分子NCl3中,N元素的化合价为-3,Cl元素的化合价为+1,请推测NCl3水解的主要产物是HClO、NH3(填化学式).
(4)X+中所有电子正好充满K、L、M三个电子层,它与N3-形成的晶体结构如右图所示.X的元素符号是Cu,与同一个N3-相连的X+有6个.
分析 (1)基态N3-的核外有10个电子,根据构造原理书写电子排布式;
(2)等电子体结构相似,CO与N2互为等电子体,则CO和氮气结构相似,根据氮气结构式书写CO结构式;
(3)在极性分子NCl3中,N元素的化合价为-3,Cl元素的化合价为+1,NCl3水解生成氨气和HClO;
(4)X+中所有电子正好充满K、L、M三个电子层,X原子核外电子数=2+8+18+1=29,则X为Cu元素,该晶胞中白色小球=8×$\frac{1}{8}$=1,黑色小球=12×$\frac{1}{4}$=3,N3-带3个单位负电荷、Cu+带1个单位正电荷,所以形成的化合物为Cu3N,则白色小球表示N3-、黑色小球表示Cu+,同一个N3-相连的Cu+有6个.
解答 解:(1)基态N3-的核外有10个电子,根据构造原理书写电子排布式为1s22s22p6,故答案为:1s22s22p6;
(2)等电子体结构相似,CO与N2互为等电子体,则CO和氮气结构相似,根据氮气结构式知CO结构式为C≡O,故答案为:C≡O;
(3)在极性分子NCl3中,N元素的化合价为-3,Cl元素的化合价为+1,因为水解反应相当于复分解反应,各元素化合价不变,所以NCl3水解生成氨气和HClO,所以其产物是HClO、NH3,
故答案为:HClO、NH3;
(4)X+中所有电子正好充满K、L、M三个电子层,X原子核外电子数=2+8+18+1=29,则X为Cu元素,该晶胞中白色小球=8×$\frac{1}{8}$=1,黑色小球=12×$\frac{1}{4}$=3,N3-带3个单位负电荷、Cu+带1个单位正电荷,所以形成的化合物为Cu3N,则白色小球表示N3-、黑色小球表示Cu+,同一个N3-相连的Cu+有6个,
故答案为:Cu;6.
点评 本题考查物质结构和性质,为高频考点,涉及晶胞计算、配位数计算、等电子体、原子核外电子排布等知识点,侧重考查知识迁移及空间想象能力,注意等电子体结构和性质相似,难点是配位数的计算,题目难度中等.

 捷径训练检测卷系列答案
捷径训练检测卷系列答案 小夫子全能检测系列答案
小夫子全能检测系列答案| A. | NaCl溶液 | B. | NaNO3溶液 | C. | Na2CO3溶液 | D. | CuSO4溶液 |
| 元素代号 | I1 | I2 | I3 | I4 |
| Q | 2080 | 4000 | 6100 | 9400 |
| R | 500 | 4600 | 6900 | 9500 |
| S | 740 | 1500 | 7700 | 10500 |
| T | 580 | 1800 | 2700 | 11600 |
| U | 420 | 3100 | 4400 | 5900 |
A.Q和R B.S和T C.T和U D.R和U
(2)它们的氯化物的化学式,最可能正确的是B
A.QCl2 B.RCl C.SCl3 D.UCl4
(3)下列元素中,化学性质和物理性质最像T元素的是A
A.硼(1s22s22p1) B.铍(1s22s2)C.锂(1s22s1)D.氦(1s2)
| A. | 原子序数为34 | B. | 氢化物比HBr稳定 | ||
| C. | 非金属性比硫强 | D. | 最高价氧化物的水化物显碱性 |
| A. | 化学反应中能量变化的大小与反应物的质量多少无关 | |
| B. | 化学变化中的能量变化主要是由于化学键变化引起的 | |
| C. | 能量变化是化学反应的基本特征之一 | |
| D. | 各种物质都储存有化学能,物质的组成、结构不同,所包含的化学能也不同 |
| 元素 | Al | B | Be | C | Cl | X | Li |
| 电负性 | 1.5 | 2.0 | 1.5 | 2.5 | 3.0 | 4.0 | 1.0 |
| 元素 | Mg | N | Y | O | P | S | Si |
| 电负性 | 1.2 | 3.0 | 0.9 | 3.5 | 2.1 | 2.5 | 1.8 |
(2)推测Y为Na(填元素符号),用电子式表示X元素与Y元素的化合物的形成过程
 .
.(3)比较Y与Li的金属性强弱,可以选用的方法是ab.
a.Y单质和Li分别与水反应的剧烈程度
b.Y与Li最高价氧化物对应水化物碱性的强弱
c.Y单质与LiCl溶液反应
d.比较二者原子半径大小.
| A. | CH4 | B. | C2H6 | C. | C3H8 | D. | C4H10 |
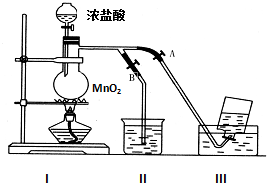 如图表示在没有通风橱收集纯净的氯气时设计的装置,图中A、B是可控制的弹簧铁夹.
如图表示在没有通风橱收集纯净的氯气时设计的装置,图中A、B是可控制的弹簧铁夹.
 ;G的结构简式HCOOCH3;
;G的结构简式HCOOCH3; .写出D与C反应生成A的化学方程式CH3OH+
.写出D与C反应生成A的化学方程式CH3OH+ +H2O.
+H2O.