题目内容
1.镁和盐酸反应太剧烈,为了减缓反应速率而又不减少产生氢气的量,在盐酸中可加入( )| A. | NaCl溶液 | B. | NaNO3溶液 | C. | Na2CO3溶液 | D. | CuSO4溶液 |
分析 盐酸与Mg反应时,为了减缓反应速率,且不影响生成氢气的总量,则减小氢离子浓度,不能改变氢离子的物质的量,因不知哪种物质过量,也不能改变Mg的物质的量即可,以此来解答.
解答 解:A、加NaCl溶液,溶液的体积增大,浓度降低,反应速率减小,但生成的气体的量不变,故A正确;
B、加入NaNO3溶液,在酸性溶液中与Mg发生氧化还原反应生成NO,不生成氢气,故B错误;
C、加Na2CO3溶液,溶液的体积增大,盐酸的浓度降低,但盐酸和碳酸钠反应生成二氧化碳,氢气的量减小,故C错误;
D、加CuSO4溶液,能形成镁铜原电池,加快反应速率,故D错误;
故选A.
点评 本题考查化学反应速率的影响因素,为高频考点,把握习题中的信息及浓度对反应速率的影响为解答的关键,注重基础知识的考查,加NaNO3固体为解答的易错点,题目难度不大.

练习册系列答案
 口算题卡北京妇女儿童出版社系列答案
口算题卡北京妇女儿童出版社系列答案
相关题目
12.分子式为C8H10的苯的同系物的种数是( )
| A. | 3种 | B. | 4种 | C. | 5种 | D. | 6种 |
9.某溶液中含有HCO3-、CO32-、SO32-、Na+、NO3-五种离子.若向其中加入Na2O2充分反应后(溶液体积变化忽略不计),溶液中离子浓度保持不变的是( )
| A. | NO3- | B. | CO32-、NO3- | C. | SO32-、NO3- | D. | CO32-、NO3-、Na+ |
10.将纯锌片和纯铜片按图示方式插入同浓度的稀硫酸中一段时间,以下叙述正确的是( )
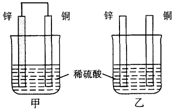

| A. | 两烧杯中铜片表面均无气泡产生 | B. | 甲中铜片是正极,乙中铜片是负极 | ||
| C. | 两烧杯中硫酸溶液的浓度均下降 | D. | 产生气泡的速度甲比乙慢 |
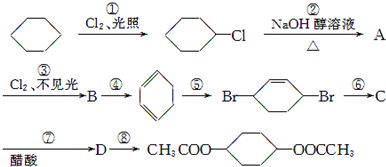
 ,C:
,C: .
. +2NaCl+2H2O
+2NaCl+2H2O
 .
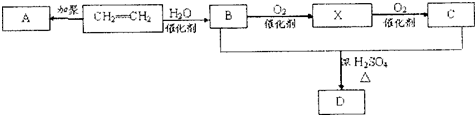
.
 .
.
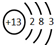 .
.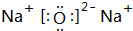 、
、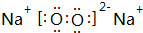 .(写两个)
.(写两个) 氮是地球上极为丰富的元素.
氮是地球上极为丰富的元素.