题目内容
3.元素的电负性的大小可以作为判断元素金属性与非金属性强弱的尺度.表为部分短周期元素的电负性.请回答下列问题.| 元素 | Al | B | Be | C | Cl | X | Li |
| 电负性 | 1.5 | 2.0 | 1.5 | 2.5 | 3.0 | 4.0 | 1.0 |
| 元素 | Mg | N | Y | O | P | S | Si |
| 电负性 | 1.2 | 3.0 | 0.9 | 3.5 | 2.1 | 2.5 | 1.8 |
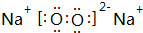
(2)推测Y为Na(填元素符号),用电子式表示X元素与Y元素的化合物的形成过程
 .
.(3)比较Y与Li的金属性强弱,可以选用的方法是ab.
a.Y单质和Li分别与水反应的剧烈程度
b.Y与Li最高价氧化物对应水化物碱性的强弱
c.Y单质与LiCl溶液反应
d.比较二者原子半径大小.
分析 (1)电负性表示对键合电子的吸引力,电负性越大对键合电子吸引力越大,所以电负性越强非金属性越强;
(2)由表中数据可知,同周期自左而右电负性增大,同主族自上而下电负性降低,所以Y为Na;X为F,据此书写用电子式表示形成化合物NaF的形成过程;氟化钠是离子化合物,用电子式表示其形成过程时,左边是原子的电子式,右边为氟化钠的电子式,中间用箭头连接;
(3)比较元素的金属性强弱,可根据金属与水、酸反应的剧烈程度以及对应的最高价氧化物的水化物的碱性强弱判断,以此解答该题.
解答 解:(1)电负性表示对键合电子的吸引力,电负性越大对键合电子吸引力越大,所以电负性越强非金属性越强,故答案为:非金属性;
(2)由表中数据可知,同周期自左而右电负性增大,同主族自上而下电负性降低,Y电负性为0.9,介于Li1.0和Mg1.2间为Na,X电负性最大,为F元素,NaF为离子化合物,书写电子式时注意,左边写钠原子和氟原子电子式,右边写氟化钠的电子式,中间用箭头连接,用电子式表示的形成过程为 ,故答案为:
,故答案为: ;
;
(3)元素的金属性越强,其单质越易与水反应,其最高价氧化物对应水化物的碱性越强,钠能与LiCl反应是钠与水反应,与金属性无关,金属性与原子半径无关,故答案为:ab.
点评 本题考查考查电负性及与金属性非金属性的关系、用电子式表示常见物质的形成过程等,题目难度不大,清楚主族元素电负性的递变规律、明确电子式的概念及表示方法为解答关键,注意相关基础知识的积累.

练习册系列答案
 期末1卷素质教育评估卷系列答案
期末1卷素质教育评估卷系列答案
相关题目
18.使用氢氧燃料电池的汽车已在北京街头出现.以30% KOH溶液为电解质溶液的这种电池在使用时的电极反应如下:2H2+4OH--4e-═4H2O O2+2H2O+4e-═4OH-
下列有关该氢氧燃料电池的说法中,正确的是( )
下列有关该氢氧燃料电池的说法中,正确的是( )
| A. | H2在正极发生氧化反应 | |
| B. | 供电时的总反应是 2H2+O2$\frac{\underline{\;点燃\;}}{\;}$2H2O | |
| C. | 氢氧燃料电池中反应放出的热量转变为电能 | |
| D. | 电解质溶液中OH-向负极移动 |
8.下列物质 ①乙烷 ②乙炔 ③甲苯 ④苯 ⑤聚乙烯 ⑥乙醇,其中既能与溴水反应又能与酸性高锰酸钾溶液反应的是( )
| A. | ②③④⑤ | B. | ②⑤⑥ | C. | ② | D. | ②⑤ |
13.关于化合物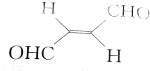 ,下列叙述正确的有( )
,下列叙述正确的有( )
 ,下列叙述正确的有( )
,下列叙述正确的有( )| A. | 分子间可形成氢键 | B. | 分子中既有极性键又有非极性键 | ||
| C. | 分子中有7个σ键和1个π键 | D. | C原子的杂化方式是sp2和sp3 |
 .
.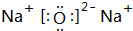 、
、 .(写两个)
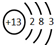
.(写两个) ,F元素原子的电子排布式1s22s22p63s23p5,E元素的原子结构示意图是
,F元素原子的电子排布式1s22s22p63s23p5,E元素的原子结构示意图是
 氮是地球上极为丰富的元素.
氮是地球上极为丰富的元素. ;
; ;
;