题目内容
6.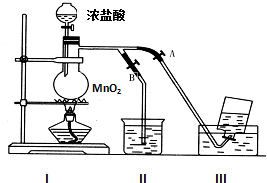 如图表示在没有通风橱收集纯净的氯气时设计的装置,图中A、B是可控制的弹簧铁夹.
如图表示在没有通风橱收集纯净的氯气时设计的装置,图中A、B是可控制的弹簧铁夹.(1)I是氯气发生装置,其中发生反应的化学方程式为MnO4+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O.
(2)用下列两种方法制取氯气:①用含氯化氢146g的浓盐酸与足量的二氧化锰反应 ②用87g二氧化锰与足量的浓盐酸反应,则所得氯气A.
A.②比①多 B.①比②多 C.一样多 D.无法比较
(3)装置Ⅱ中盛放的液体是NaOH溶液,其作用是吸收多余的Cl2,防止污染空气,装置Ⅲ中应盛放的液体是饱和食盐水.
(4)简述收集氯气的操作过程中,如何控制弹簧夹A、B.(从氯气已经产生开始)在收集氯气之前,应打开B,关闭A;当氯气纯度合乎要求时,应打开A,关闭B;当氯气收集完毕时,应打开B,关闭A.
分析 (1)I是氯气发生装置,其中发生反应的是二氧化锰和浓盐酸加热反应生成氯化锰、氯气和水;
(2)浓盐酸与MnO2发生化学反应,随着反应的进行,盐酸的浓度降低,还原性减弱,稀盐酸与MnO2不反应,以此解答该题;
(3)实验室用二氧化锰和浓盐酸在加热条件下生成氯气;氯气在饱和氯化钠溶液中的溶解度较小,实验室常用排饱和食盐水法收集氯气;氯气有毒需要尾气吸收常用氢氧化钠溶液吸收;
(4)收集氯气时,应关闭b,打开a,用排饱和食盐水法收集;收集完毕,关闭a,打开b,用氢氧化钠溶液吸收多余氯气;
解答 解:(1)I是氯气发生装置,其中发生反应的是二氧化锰和浓盐酸加热反应生成氯化锰、氯气和水,反应的化学方程式为:MnO4+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O,
故答案为:MnO4+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O;
(2)反应的化学方程式为:4HCl(浓)+MnO2 $\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O,
①n(HCl)=$\frac{146g}{36.5g/mol}$=4mol,n(MnO2)=$\frac{174g}{87g/mol}$=2mol,浓盐酸与MnO2发生化学反应,随着反应的进行,盐酸的浓度降低,还原性减弱,稀盐酸与MnO2不反应,所以生成的n(Cl2)<1mol;
②n(MnO2)=$\frac{87g}{87g/mol}$=1mol,由于浓盐酸足量,生成的n(Cl2)=1mol,所以所得C12②比①多,
故答案为:A;
(3)氯气有毒,可污染空气,要进行尾气吸收,氯气和氢氧化钠反应生成氯化钠、次氯酸钠和水,所以常用氢氧化钠溶液吸收吸收多余的Cl2,防止污染空气;氯气在饱和氯化钠溶液中的溶解度较小,实验室常用排饱和食盐水法收集氯气,
故答案为:氢氧化钠溶液;吸收多余的Cl2,防止污染空气;饱和食盐水;
(4)氯气在饱和氯化钠溶液中的溶解度很小,实验室常用排饱和食盐水法收集氯气,收集时,为得到较为纯净的氯气,应先排除装置内的空气,则应关闭A,打开B;收集时,应关B开A,收集完毕,关闭A,打开B,
故答案为:B、A;A、B;B、A.
点评 本题考查了氯气的制备和有关方程式的计算,熟悉氯气的制备原理和性质是解题关键,题目难度不大.

(1)将锌片和银片浸入稀硫酸中组成原电池,两电极间连接一个电流计.锌片做负极(填“正”或“负”),锌片上发生的电极反应式是Zn-2e-=Zn2+;银片上发生的电极反应式是2H++2e-=H2↑.
(2)若该电池中两电极的总质量为60g,工作一段时间后,取出锌片和银片洗净干燥后称重,总质量为47g.此时产生标准状况下氢气的体积为4.48L,通过导线的电子的物质的量为0.4mol.
(3)为证明铁的金属活动性比铜强,某同学设计了如下一些方案.其中能证明铁的金属活动性比铜强的方案是①③④.(填序号)
| 方 案 | 现象或产物 |
| ①将铁片置于CuSO4溶液中 | 铁片上有亮红色物质析出 |
| ②将铁丝和铜丝分别在氯气燃烧 | 产物分别为FeCl3和CuCl2 |
| ③将铁片和铜片分别置于稀硫酸溶液中 | 铁片上有气泡产生,铜片上无气泡产生 |
| ④将铁片和铜片置于盛有稀硫酸的烧杯中,并用导线连接 | 铁片溶解,铜片上有气泡产生 |
①一个H-H键断裂的同时有两个H-I键断裂;②HI浓度等于I2浓度;③反应速率v正(H2)=v逆(HI);④HI、H2、I2分子数之比为2:1:1;⑤容器内压强不变;⑥容器内气体颜色不再变化.
| A. | ①③⑤ | B. | ②⑥ | C. | ④⑤ | D. | ①⑥ |
下列有关该氢氧燃料电池的说法中,正确的是( )
| A. | H2在正极发生氧化反应 | |
| B. | 供电时的总反应是 2H2+O2$\frac{\underline{\;点燃\;}}{\;}$2H2O | |
| C. | 氢氧燃料电池中反应放出的热量转变为电能 | |
| D. | 电解质溶液中OH-向负极移动 |

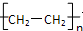 .
. ,F元素原子的电子排布式1s22s22p63s23p5,E元素的原子结构示意图是
,F元素原子的电子排布式1s22s22p63s23p5,E元素的原子结构示意图是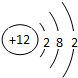
 氮是地球上极为丰富的元素.
氮是地球上极为丰富的元素. ;
; ;
;