题目内容
15.下列混合溶液中,各离子浓度的大小顺序正确的是( )| A. | 10mL0.5mol/LCH3COONa溶液与6mL1mol/L盐酸混合c(Clˉ)>c(Na+)>c(OHˉ)>c(H+) | |
| B. | 10mL0.1mol/LNH4 Cl溶液与5mL0.2mol/LNaOH溶液混合c(Na+)=c(Clˉ)>c(OHˉ)>c(H+) | |
| C. | 10mL0.1mol/LCH3COOH溶液与5mL0.2mol/LNaOH溶液混合c(Na+)=c(CH3COOˉ)>c(OHˉ)>c(H+) | |
| D. | 10mL0.1mol/L氨水与10mL0.1mol/L盐酸混合 c(Clˉ)>c(NH4+)>c(OHˉ)>c(H+) |
分析 A.醋酸钠和盐酸混合,醋酸钠的物质的量小于盐酸,二者混合有溶液中的溶质是醋酸、氯化钠和盐酸,溶液呈酸性;
B.10mL0.1mol/LNH4Cl溶液与5mL0.2mol/LNaOH混合,氯化铵和氢氧化钠的物质的量相等,等物质的量的氯化铵和氢氧化钠溶液混合后,二者恰好反应生成等物质的量的氯化钠和一水合氨,溶液呈碱性,根据电荷守恒和物料守恒分析;
C.等物质的量的醋酸和氢氧化钠混合,二者恰好反应生成醋酸钠和水,醋酸钠是强碱弱酸盐,醋酸根离子水解,溶液显示碱性,醋酸根离子浓度小于钠离子;
D.等浓度、等体积氨水和盐酸混合,二者恰好反应生成氯化铵,氯化铵是强酸弱碱盐,铵根离子部分水解,其溶液呈酸性.
解答 解:A.醋酸钠和盐酸混合,醋酸钠的物质的量小于盐酸,二者混合有溶液中的溶质是醋酸、氯化钠和盐酸,溶液呈酸性,则c(H+)>c(OH-),溶液中正确的离子浓度关系为:c(Cl-)>c(Na+)>c(H+)>c(OH-),故A错误;
B.等物质的量的氯化铵和氢氧化钠溶液混合,二者恰好反应生成等物质的量的氯化钠和一水合氨,溶液呈碱性,则c(OH-)>c(H+),根据物料守恒知:c(Na+)=c(Cl-),则溶液中离子浓度关系为:c(Na+)=c(Cl-)>c(OH-)>c(H+),故B正确;
C.等物质的量的醋酸和氢氧化钠混合,二者恰好反应生成醋酸钠和水,醋酸钠是强碱弱酸盐,其溶液呈碱性,所以c(OH-)>c(H+),醋酸钠溶液中c(CH3COO-)>c(OH-),根据电荷守恒得c(Na+)>c(CH3COO-),所以离子浓度大小顺序为:c(Na+)>c(CH3COO-)>c(OH-)>c(H+),故C错误;
D.等浓度、等体积的氨水和盐酸混合,二者恰好反应生成氯化铵,氯化铵是强酸弱碱盐其溶液呈酸性,所以c(H+)>c(OH-),溶液中正确的离子浓度大小为:c(Cl-)>c(NH4+)>c(H+)>c(OH-),故D错误;
故选B.
点评 本题考查了混合溶液中离子浓度大小的比较,题目浓度中等,根据n=cV计算出各物质的物质的量然后正确判断反应后的溶质组成为解答关键,注意电荷守恒、物料守恒、盐的水解原理在判断离子浓度大小中的应用方法.

| A. | n1=n2 | B. | n1>n2 | C. | n1<n2 | D. | c(A-)<c(B-) |
| A. | 溶液中NaOH的物质的量 | B. | 溶液中Na+的物质的量浓度 | ||
| C. | 溶液中Na+的数目 | D. | 溶液的质量 |
| A. | 标准状况下44.8L H2 | B. | 88gCO2 | ||
| C. | 9.03ⅹ1023个CH4 分子 | D. | 3molH2O |
| 选项 | 被提纯的物质 | 杂质 | 除杂试剂 | 除杂方法 |
| A | CO2 (g) | SO2(g) | 饱和Na2CO3溶液、浓H2SO4 | 洗气 |
| B | NH4Cl(aq) | Fe3+(aq) | NaOH溶液 | 过滤 |
| C | NaCl(s) | KNO3(s) | AgNO3溶液 | 过滤 |
| D | Cu(s) | Ag(s) | CuSO4溶液 | 电解法 |
| A. | A | B. | B | C. | C | D. | D |
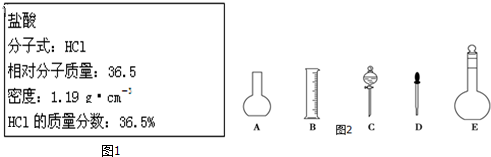
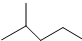 表示的分子式C6H14;名称是2-甲基戊烷,核磁共振氢谱中有5组峰.
表示的分子式C6H14;名称是2-甲基戊烷,核磁共振氢谱中有5组峰.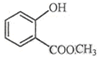 中含有的官能团的名称为羟基、酯基.
中含有的官能团的名称为羟基、酯基.