题目内容
20.用40mL0.5mol•L-1的MCln,其中的Mn+恰好将15mL 2mol•L-1Na2CO3碳酸根离子完全沉淀,则n值为( )| A. | 1 | B. | 2 | C. | 3 | D. | 4 |
分析 根据Na2CO3溶液与MCln盐溶液反应时,恰好将溶液中的Mn+离子完全沉淀为碳酸盐,利用化合价得出Mn+离子与CO32-离子的关系,然后利用物质的量来计算解答.
解答 解:Na2CO3溶液中CO32-离子的物质的量为15mL×10-3×2mol•L-1=0.03mol,
MCln盐溶液中Mn+离子的物质的量为40mL×10-3×0.5mol•L-1=0.02mol,
由反应中恰好将溶液中的Mn+离子完全沉淀为碳酸盐,及M的化合价为+n,
则Na2CO3与MCln反应对应的关系式为:
2Mn+~nCO32-
2 n
0.02mol 0.03mol
$\frac{2}{n}$=$\frac{0.02}{0.03}$,解得n=3,
故选B.
点评 本题考查学生利用溶液中的离子之间的反应来进行简单计算,明确离子之间的关系是解答的关键,并应熟悉离子的物质的量的计算来解答即可,题目难度不大.

练习册系列答案
相关题目
10.下列说法正确的是( )
| A. | 由H原子形成1 mol H-H键要吸收热量 | |
| B. | 所有燃烧反应都是放热反应 | |
| C. | 在稀溶液中,1 mol酸与1 mol碱发生中和反应生成水时所释放的热量称为中和热 | |
| D. | 在一定条件下,1mol H2 与足量的Cl2、Br2、I2 分别反应,放出热量关系是I2>Br2>Cl2 |
8.下列实验结论正确的是( )
| A. | 将某无色气体通入溴水中,溴水颜色褪去,该气体一定是SO2 | |
| B. | 用铂丝蘸取少量某溶液进行焰色反应,火焰呈黄色,该溶液中一定不含K+ | |
| C. | 向某溶液中滴加KSCN溶液不变色,滴加氯水后溶液显红色,原溶液中一定含Fe2+ | |
| D. | 向某溶液中加入稀盐酸,产生的气体能使澄清石灰水变浑浊,该溶液一定是碳酸盐溶液 |
15.下列混合溶液中,各离子浓度的大小顺序正确的是( )
| A. | 10mL0.5mol/LCH3COONa溶液与6mL1mol/L盐酸混合c(Clˉ)>c(Na+)>c(OHˉ)>c(H+) | |
| B. | 10mL0.1mol/LNH4 Cl溶液与5mL0.2mol/LNaOH溶液混合c(Na+)=c(Clˉ)>c(OHˉ)>c(H+) | |
| C. | 10mL0.1mol/LCH3COOH溶液与5mL0.2mol/LNaOH溶液混合c(Na+)=c(CH3COOˉ)>c(OHˉ)>c(H+) | |
| D. | 10mL0.1mol/L氨水与10mL0.1mol/L盐酸混合 c(Clˉ)>c(NH4+)>c(OHˉ)>c(H+) |
5. 奥运会会标是五环旗,假定奥运五环旗中的每一环表示一种物质,相连环物质间一定条件下能发生常见反应,不相连环物质间不能发生反应.且四种反应中必须包含化合反应、置换反应及复分解反应,适合的一组是( )
奥运会会标是五环旗,假定奥运五环旗中的每一环表示一种物质,相连环物质间一定条件下能发生常见反应,不相连环物质间不能发生反应.且四种反应中必须包含化合反应、置换反应及复分解反应,适合的一组是( )
 奥运会会标是五环旗,假定奥运五环旗中的每一环表示一种物质,相连环物质间一定条件下能发生常见反应,不相连环物质间不能发生反应.且四种反应中必须包含化合反应、置换反应及复分解反应,适合的一组是( )
奥运会会标是五环旗,假定奥运五环旗中的每一环表示一种物质,相连环物质间一定条件下能发生常见反应,不相连环物质间不能发生反应.且四种反应中必须包含化合反应、置换反应及复分解反应,适合的一组是( )| 选项 | 蓝 | 黑 | 红 | 黄 | 绿 |
| A | SiO2 | Fe SO4溶液 | O2 | NaOH溶液 | Cu |
| B | O2 | 稀H2SO4 | CO2 | Fe | NaOH溶液 |
| C | O2 | 稀H2SO4 | Al(OH)3 | NH3 | NaOH |
| D | Mg | CO2 | KOH溶液 | Al | Fe2O3 |
| A. | A | B. | B | C. | C | D. | D |
12. 如图两个装置中,液体体积均为200mL,开始工作前电解质溶液的浓度均为0.5mol/L,工作一段时间后,测得有0.02mol电子通过,若忽略溶液体积的变化,下列叙述正确的是( )
如图两个装置中,液体体积均为200mL,开始工作前电解质溶液的浓度均为0.5mol/L,工作一段时间后,测得有0.02mol电子通过,若忽略溶液体积的变化,下列叙述正确的是( )
 如图两个装置中,液体体积均为200mL,开始工作前电解质溶液的浓度均为0.5mol/L,工作一段时间后,测得有0.02mol电子通过,若忽略溶液体积的变化,下列叙述正确的是( )
如图两个装置中,液体体积均为200mL,开始工作前电解质溶液的浓度均为0.5mol/L,工作一段时间后,测得有0.02mol电子通过,若忽略溶液体积的变化,下列叙述正确的是( )| A. | 产生气体体积 ①=② | |
| B. | ①中阴极质量增加,②中正极质量减小 | |
| C. | 溶液的H+浓度变化:①增大,②减小 | |
| D. | 电极反应式①中阳极:4OH--4e-═2H2O+O2↑,②中负极:2H++2e-═H2↑ |
9.常温下;在指定环境中,下列各组离子一定能大量共存的是( )
| A. | 使pH试纸呈红色的溶液中:I-、Cl0-、S032-、Na+ | |
| B. | 1.0 mol/L的KNO3溶液中:H+、Fe2+、Cl-、S042- | |
| C. | 由水电离出的C(H+)=10-13mol/L的溶液中:C032-、S042-、Cl-、Na+ | |
| D. | 在含有大量HC03-的溶液中:K+、Ba2+、Cl-、N03- |
 乙苯
乙苯 2,3-二甲基戊烷
2,3-二甲基戊烷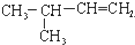 3-甲基-1-丁烯
3-甲基-1-丁烯 .
.