题目内容
10.下列气体中所含原子数最多的是( )| A. | 标准状况下44.8L H2 | B. | 88gCO2 | ||
| C. | 9.03ⅹ1023个CH4 分子 | D. | 3molH2O |
分析 根据N=nNA、N=$\frac{V}{{V}_{m}}$NA、N=$\frac{m}{M}$NA结合分子构成计算所含原子个数多少.
解答 解:A.标准状况下44.8L H2含有的原子数=$\frac{44.8L}{22.4L/mol}$×2×NA=4NA;
B.88gCO2含有的原子数=$\frac{88g}{44g/mol}$×3×NA=6NA;
C.9.03ⅹ1023个CH4分子含有的原子数=$\frac{9.03×10{\\;}^{23}}{6.02×1{0}^{23}}$×5×NA=7.5NA;
D.3molH2O含有的原子数=3mol×3×NA=9NA;
所以所含原子数最多的是3molH2O,
故选D.
点评 本题考查了物质的量的有关计算,比较基础,注意公式的使用条件,侧重于基础知识的考查,注意知识的积累.

练习册系列答案
相关题目
20.某实验小组设计实验测定Na2S04和Na2C03混合物中各组分的含量.

下列说法不正确的是( )

下列说法不正确的是( )
| A. | 沉淀a的主要成分是BaS04和BaC03 | |
| B. | 滤液b中Na+的物质的量为0.08 mol | |
| C. | 气体d在标准状况下的体积为224 mL | |
| D. | 原混合物中Na2S04与Na2C03的物质的量之比为1:3 |
1.下列物质所属的类别及其所含官能团的对应关系不正确的是( )
| A. | CH3CH=CH2 烯烃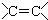 | B. | 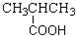 羧酸-COOH 羧酸-COOH | ||
| C. |  醛类 醛类 | D. | RCH2OH (R为烃基) 醇类-OH |
5.在含有Cu(NO3)2、Zn(NO3)2、Fe(NO3)3各0.01mol的混和溶液中,加入0.01mol的铁粉,经充分搅拌后,产生的变化是( )
| A. | 铁溶解,析出0.01molZn | |
| B. | 铁溶解,析出铜,且溶液中不含有Fe3+ | |
| C. | 铁溶解,析出0.01molCu | |
| D. | 铁溶解,溶液中金属阳离子只剩Fe2+和Zn2+ |
15.下列混合溶液中,各离子浓度的大小顺序正确的是( )
| A. | 10mL0.5mol/LCH3COONa溶液与6mL1mol/L盐酸混合c(Clˉ)>c(Na+)>c(OHˉ)>c(H+) | |
| B. | 10mL0.1mol/LNH4 Cl溶液与5mL0.2mol/LNaOH溶液混合c(Na+)=c(Clˉ)>c(OHˉ)>c(H+) | |
| C. | 10mL0.1mol/LCH3COOH溶液与5mL0.2mol/LNaOH溶液混合c(Na+)=c(CH3COOˉ)>c(OHˉ)>c(H+) | |
| D. | 10mL0.1mol/L氨水与10mL0.1mol/L盐酸混合 c(Clˉ)>c(NH4+)>c(OHˉ)>c(H+) |
19.用NA表示阿伏加德罗常数的值,下列说法正确的是( )
| A. | 24.5L氢气中所含氢原子数一定大于2NA | |
| B. | 1molCH3+电子数为9NA | |
| C. | 100g 60%CH3COOH水溶液中含有的分子数为NA | |
| D. | 常温常压下0.1mol CO和NO的混合气体含氧原子数为0.1NA |
20.下列物质中,不属于有机物的是( )
| A. | 氰化钠(NaCN) | B. | 醋酸(CH3COOH) | C. | 乙炔(C2H2) | D. | 碳化硅(SiC) |
 实验室测定碳酸钠和碳酸氢钠混合物中碳酸钠的质量分数W(Na2CO3),称取此混合物5.0g,溶于水中,配成250mL溶液.
实验室测定碳酸钠和碳酸氢钠混合物中碳酸钠的质量分数W(Na2CO3),称取此混合物5.0g,溶于水中,配成250mL溶液.