题目内容
3.如图1为实验室某浓盐酸试剂瓶标签上的有关数据,试根据标签上的有关数据回答下列问题: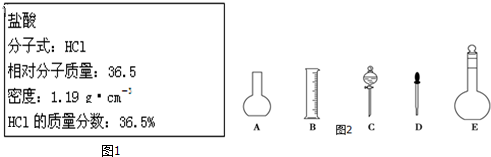
(1)该浓盐酸中HCl的物质的量浓度为11.9mol•L-1.
(2)取用任意体积的该盐酸溶液时,下列物理量中不随所取体积的多少而变化的是BC.
A.溶液中HCl的物质的量 B.溶液的浓度
C.溶液的密度 D.溶液中Cl-的数目
(3)如图2所示的仪器中配制溶液肯定不需要的是AC(填序号),配制上述溶液还需用到的玻璃仪器是烧杯、玻璃棒(填仪器名称).
(4)容量瓶不能用于BCF(填序号).
A.配制一定体积准确浓度的标准溶液
B.贮存溶液
C.测量容量瓶规格以下的任意体积的液体
D.准确稀释某一浓度的溶液
E.量取一定体积的液体
F.用来加热溶解固体溶质
(5)某学生欲用上述浓盐酸和蒸馏水配制480mL物质的量浓度为0.200mol•L-1的稀盐酸.
①该学生需要用量筒量取8.4mL上述浓盐酸进行配制.
②在配制过程中,下列实验操作会使所配制的稀盐酸的物质的量浓度偏大的有B C.
A.转移溶液后未洗涤烧杯和玻璃棒就直接定容
B.用量筒量取浓盐酸时仰视观察凹液面
C.在容量瓶中定容时俯视刻度线
D.定容后把容量瓶倒置摇匀,发现液面低于刻度线,又加水至刻度线
E.定容时,加蒸馏水超过刻度线,又用胶头滴管吸出.
分析 (1)根据c=$\frac{1000ρω}{M}$计算该浓盐酸中HCl的物质的量浓度;
(2)根据该物理量是否有溶液的体积有关判断;
(3)根据配制有的物质的量浓度的溶液的步骤选择使用的仪器;
(4)根据容量瓶的构造及正确使用方法进行解答;
(5)①依据溶液稀释过程中溶质的物质的量不变计算需要浓盐酸体积;
②分析操作对溶质的物质的量和溶液的体积的影响,依据C=$\frac{n}{V}$进行误差分析.
解答 解:(1)质量分数36.5%,密度为1.19g/mL的盐酸的物质的量浓度C=$\frac{1000×1.19×36.5%}{36.5}$=11.9mol/L;
故答案为:11.9;
(2)A.溶液中HCl的物质的量=nV,所以与溶液的体积有关,故A不选;
B.溶液具有均一性,溶液浓度与溶液的体积无关,故B选;
C.溶液的密度与溶液的体积无关,故C选;
D.溶液中Cl-的数目=nNA=CVNA,所以与溶液的体积有关,故D不选;
故选:BC;
(3)配制一定物质的量浓度溶液的步骤为:计算、量取、稀释、冷却、转移、洗涤、定容、摇匀等,需要的仪器有:量筒、烧杯、玻璃棒、容量瓶、胶头滴管,所以不需要的是:平底烧瓶和分液漏斗;所以还需要烧杯和玻璃棒;
故答案为:AC 烧杯、玻璃棒;
(4)A.容量瓶为定容仪器,用于配制一定体积的、浓度准确的溶液,故A正确;
B.容量瓶为精密仪器,不能用于贮存溶液,故B错误;
C.容量瓶不能配制或测量容量瓶规格以下的任意体积的液体,故C错误;
D.容量瓶能准确稀释某一浓度的溶液,故D正确;
E.容量瓶上有容积刻度线,可以量取一定体积的液体,故E正确;
F.容量瓶为精密仪器,不能用来加热溶解固体溶质,故F错误;
故答案为:BCF;
(5)①配制480mL物质的量浓度为0.200mol•L-1的稀盐酸,应选择500mL容量瓶,设需要浓盐酸体积为V,则依据溶液稀释过程中溶质的物质的量不变得:V×11.9mol/L=0.2,mol/L×0.5L,解得V=0.0084L,即V=8.4mL;
故答案为:8.4;
②A.转移溶液后未洗涤烧杯和玻璃棒就直接定容,导致溶质的物质的量偏小,溶液浓度偏低,故A不选;
B.用量筒量取浓盐酸时仰视观察凹液面,导致量取的浓盐酸体积偏大,氯化氢的物质的量偏大,溶液浓度偏高,故B选;
C.在容量瓶中定容时俯视刻度线,导致溶液体积偏小,溶液浓度偏高,故C选;
D.定容后把容量瓶倒置摇匀,发现液面低于刻度线,又加水至刻度线,导致溶液体积偏大,溶液浓度偏低,故D不选;
E.定容时,加蒸馏水超过刻度线,又用胶头滴管吸出,导致溶质的物质的量偏小,溶液浓度偏低,故D不选;
故选:BC.
点评 本题考查了配制一定物质的量浓度的溶液的方法及误差分析,题目难度不大,要求学生掌握配制一定物质的量浓度的溶液的步骤及误差分析的方法与技巧,注意容量瓶规格的选择.

| A. | 将某无色气体通入溴水中,溴水颜色褪去,该气体一定是SO2 | |
| B. | 用铂丝蘸取少量某溶液进行焰色反应,火焰呈黄色,该溶液中一定不含K+ | |
| C. | 向某溶液中滴加KSCN溶液不变色,滴加氯水后溶液显红色,原溶液中一定含Fe2+ | |
| D. | 向某溶液中加入稀盐酸,产生的气体能使澄清石灰水变浑浊,该溶液一定是碳酸盐溶液 |
| A. | 10mL0.5mol/LCH3COONa溶液与6mL1mol/L盐酸混合c(Clˉ)>c(Na+)>c(OHˉ)>c(H+) | |
| B. | 10mL0.1mol/LNH4 Cl溶液与5mL0.2mol/LNaOH溶液混合c(Na+)=c(Clˉ)>c(OHˉ)>c(H+) | |
| C. | 10mL0.1mol/LCH3COOH溶液与5mL0.2mol/LNaOH溶液混合c(Na+)=c(CH3COOˉ)>c(OHˉ)>c(H+) | |
| D. | 10mL0.1mol/L氨水与10mL0.1mol/L盐酸混合 c(Clˉ)>c(NH4+)>c(OHˉ)>c(H+) |
 如图两个装置中,液体体积均为200mL,开始工作前电解质溶液的浓度均为0.5mol/L,工作一段时间后,测得有0.02mol电子通过,若忽略溶液体积的变化,下列叙述正确的是( )
如图两个装置中,液体体积均为200mL,开始工作前电解质溶液的浓度均为0.5mol/L,工作一段时间后,测得有0.02mol电子通过,若忽略溶液体积的变化,下列叙述正确的是( )| A. | 产生气体体积 ①=② | |
| B. | ①中阴极质量增加,②中正极质量减小 | |
| C. | 溶液的H+浓度变化:①增大,②减小 | |
| D. | 电极反应式①中阳极:4OH--4e-═2H2O+O2↑,②中负极:2H++2e-═H2↑ |
| A. | KClO3和SO3溶于水后能导电,故KClO3和SO3为电解质 | |
| B. | HClO是弱酸,所以NaClO是弱电解质 | |
| C. | HCl溶液和NaCl溶液均通过离子导电,所以HCl和NaCl均是离子化合物 | |
| D. | BaSO4 和NaHCO3都是强电解质 |



