题目内容
12.A、B、C、D、E是原子序数依次增大的短周期主族元素,A、D在周期表中的相对位置如右表;A元素最低负化合价的绝对值与其原子最外层电子数相等;C是地壳中含量最多的金属元素.| A | ||||
| D |

(2)B元素的最高氧化物对应的水化物与它的氢化物反应得到离子化合物,则B元素的单质分子空间构型为直线形,写出该单质的一种等电子体:CO、CN-等
(3)C的离子结构示意图为
 ,元素E在周期表中的位置是第3周期ⅦA族.
,元素E在周期表中的位置是第3周期ⅦA族.
分析 A元素最低负化合价的绝对值与其原子最外层电子数相等,说明A的最低化合价与最高化合价绝对值相等,则A最外层电子数为4,根据A、D是原子序数依次增大的短周期主族元素可知A为C元素,则D应为S元素,C是地壳中含量最多的金属元素,故C为Al元素,而E是原子序数最大的元素,且为短周期主族元素,故E为Cl元素,以此解答该题.
解答 解:A元素最低负化合价的绝对值与其原子最外层电子数相等,说明A的最低化合价与最高化合价绝对值相等,则A最外层电子数为4,根据A、D是原子序数依次增大的短周期主族元素可知A为C元素,则D应为S元素,C是地壳中含量最多的金属元素,故C为Al元素,而E是原子序数最大的元素,且为短周期主族元素,故E为Cl元素,
(1)A为C元素,与氢元素组成的化合物分子有6个原子,则分子式为C2H4,其结构简式为CH2=CH2,在常温下与溴水发生加成反应,化学方程式为CH2=CH2+Br2→CH2Br-CH2Br,乙烯分子间发生加成聚合反应生成高分子化合物聚乙烯;反应的化学方程式为 ,
,
故答案为:CH2=CH2;CH2=CH2+Br2→CH2Br-CH2Br; ;
;
(2)B元素的最高价氧化物对应的水化物与它的氢化物反应得到离子化合物,说明B的氢化物溶于水属于碱性,则B为N元素,单质为N2,单质分子空间构型为直线形,与氮气互为等电子体的为CO、CN-等,故答案为:直线形;CO、CN-等;
(3)C的离子为Al3+,结构示意图为 ;元素E为Cl元素,在周期表中位于第3周期ⅦA族,故答案为:
;元素E为Cl元素,在周期表中位于第3周期ⅦA族,故答案为: ;第3周期ⅦA族.
;第3周期ⅦA族.
点评 本题考查位置结构性质的相互关系应用,为高频考点,题目难度中等,侧重考查学生综合能力,需要学生熟练掌握元素化合物性质,并进行迁移应用.

练习册系列答案
 三点一测快乐周计划系列答案
三点一测快乐周计划系列答案
相关题目
3.下列关于有机物的说法正确的是( )
| A. | 乙烯和聚乙烯都能使溴的四氯化碳溶液褪色 | |
| B. | 甲烷、乙烯和苯都能与酸性高锰酸钾溶液反应 | |
| C. | 乙酸乙酯和油脂在一定条件下都能水解 | |
| D. | 所有烷烃中都存在碳碳单键 |
17. 如图装置是实验室里常见的气体发生装置,用该装置制取、提纯并收集表中的四种气体(a、b、c表示相应仪器中加入的试剂),其中可行的是( )
如图装置是实验室里常见的气体发生装置,用该装置制取、提纯并收集表中的四种气体(a、b、c表示相应仪器中加入的试剂),其中可行的是( )
 如图装置是实验室里常见的气体发生装置,用该装置制取、提纯并收集表中的四种气体(a、b、c表示相应仪器中加入的试剂),其中可行的是( )
如图装置是实验室里常见的气体发生装置,用该装置制取、提纯并收集表中的四种气体(a、b、c表示相应仪器中加入的试剂),其中可行的是( )| 气体 | a | b | c | |
| A | NO2 | 浓硝酸 | 铜片 | NaOH溶液 |
| B | SO2 | 浓硫酸 | K2SO3粉末 | 浓硫酸 |
| C | NH3 | 浓氨水 | 生石灰 | 碱石灰 |
| D | CO2 | 稀硫酸 | CaCO3粉末 | NaOH溶液 |
| A. | A | B. | B | C. | C | D. | D |
4.下列四种X溶液,均能跟相同浓度同体积的盐酸反应,其中反应最快的是( )
| 温度 | X溶液的体积(mL) | X溶液的浓度(mol/L) | 水的体积(mL) | |
| A | 10℃ | 20 | 3 | 10 |
| B | 20℃ | 30 | 2 | 0 |
| C | 20℃ | 10 | 4 | 20 |
| D | 10℃ | 10 | 2 | 20 |
| A. | A | B. | B | C. | C | D. | D |
1.下列表示正确的是( )
| A. | CO2的比例模型: | B. | 铝原子的结构示意图: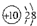 | ||
| C. | 次氯酸的结构式:H-Cl-O | D. | NH3的电子式: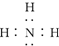 |
2.下列说法或表示方法正确的是( )
| A. | 醛基的电子式: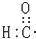 | B. | 乙烯的结构简式:CH2CH2 | ||
| C. | 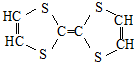 属于有机物 属于有机物 | D. | 聚丙烯的化学式: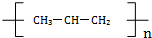 |
 利用如图装置,验证CO2的性质.
利用如图装置,验证CO2的性质.
 .
. .
.