题目内容
1.下列表示正确的是( )| A. | CO2的比例模型: | B. | 铝原子的结构示意图: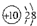 | ||
| C. | 次氯酸的结构式:H-Cl-O | D. | NH3的电子式: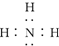 |
分析 A.比例模型表示原子的相对大小及原子连接顺序、空间结构;
B.铝原子的核电荷数为13,核外电子数为13,最外层为3个电子;
C.次氯酸的中心原子为氧原子,分子中不存在氢氯键;
D.氨气分子中存在3个氮氢键,氮原子最外层达到8电子稳定结构.
解答 解:A.CO2的比例(填充)模型中,碳原子的原子半径大于氧原子,其正确的比例模型为: ,故A错误;
,故A错误;
B.铝原子的核电荷数=核外电子总数=13,其正确的原子结构示意图为: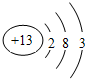 ,故B错误;
,故B错误;
C.次氯酸中氧原子与氯原子、氢原子之间分别形成1对共用电子对,正确的结构式为:H-O-Cl,故C错误;
D.氨气为共价化合物,其分子中存在3个氮氢键,其电子式为: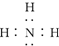 ,故D正确;
,故D正确;
故选D.
点评 本题考查了常见化学用语的判断,题目难度中等,涉及电子式、比例模型、原子结构示意图、结构式等知识,注意熟练掌握常见化学用语的概念及书写原则,试题培养了学生的规范答题能力.

练习册系列答案
 捷径训练检测卷系列答案
捷径训练检测卷系列答案 小夫子全能检测系列答案
小夫子全能检测系列答案
相关题目
11.下列有关叙述正确的是( )
| A. | 两原子之间形成共价键时,可形成2个σ键 | |
| B. | 将铁制品做炊具,金属键没有被破坏 | |
| C. | 温度越高,金属的导电性越好 | |
| D. | 任何晶体都含化学键. |
12.A、B、C、D、E是原子序数依次增大的短周期主族元素,A、D在周期表中的相对位置如右表;A元素最低负化合价的绝对值与其原子最外层电子数相等;C是地壳中含量最多的金属元素.
(1)A与氢元素组成的化合物分子有6个原子,其结构简式为CH2=CH2,写出该化合物在常温下使溴水褪色的化学方程式CH2=CH2+Br2→CH2Br-CH2Br,该化合物还是一种重要的化工原料,写出其加聚生成高分子的化学方程式:
(2)B元素的最高氧化物对应的水化物与它的氢化物反应得到离子化合物,则B元素的单质分子空间构型为直线形,写出该单质的一种等电子体:CO、CN-等
(3)C的离子结构示意图为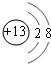 ,元素E在周期表中的位置是第3周期ⅦA族.
,元素E在周期表中的位置是第3周期ⅦA族.
| A | ||||
| D |

(2)B元素的最高氧化物对应的水化物与它的氢化物反应得到离子化合物,则B元素的单质分子空间构型为直线形,写出该单质的一种等电子体:CO、CN-等
(3)C的离子结构示意图为
 ,元素E在周期表中的位置是第3周期ⅦA族.
,元素E在周期表中的位置是第3周期ⅦA族.
9.下列有关实验的做法或说法正确的是( )
| A. | 在制备乙烯的实验中,加热时应使温度缓慢上升至170°C | |
| B. | 在苯酚溶液中滴入少量稀溴水出现白色沉淀 | |
| C. | 将溴乙烷滴入NaOH溶液中,待充分反应再加入AgNO3溶液后有浅黄色沉淀生成 | |
| D. | 将铜丝在酒精灯上加热后,立即伸入无水乙醇中,铜丝恢复成原来的红色 |
16.可用于区别苯酚、乙醇、氢氧化钠、硝酸银、硫氰化钾五种溶液的一种试剂是( )
| A. | FeCl3溶液 | B. | 石蕊试液 | C. | 浓溴水 | D. | FeCl2溶液 |
6.锂电池是一代新型高能电池,它以质量轻、能量高而受到了普遍重视,目前已研制成功多种锂电池. 某种锂电池的总反应式是Li+MnO2=LiMnO2.下列说法正确的是( )
| A. | Li是负极,电极反应为Li+e-=Li+ | |
| B. | Li是正极,电极反应为Li+e-=Li- | |
| C. | MnO2是负极,电极反应为MnO2+e-=MnO2- | |
| D. | 锂电池是一种环保型电池 |
13.使用氢氧燃料电池的公共汽车已在北京街头出现.某种以30%KOH溶液为电解质的氢氧燃料电池在使用时的电极反应如下:2H2+4OH--4e-═4H2O O2+2H2O+4e-═4OH-.下列有关该氢氧燃料电池的说法中,正确的是( )
| A. | H2在正极发生氧化反应 | |
| B. | 供电时的总反应为:2H2+O2$\frac{\underline{\;点燃\;}}{\;}$2H2O | |
| C. | 氢氧燃料电池中H2和O2燃烧放出的热量转变为电能 | |
| D. | 氢氧燃料电池产物是水,属于环境友好电池 |
10.下列各组顺序的排列不正确的是( )
| A. | 原子半径:Na<Mg | B. | 热稳定性:HCl>H2S | ||
| C. | 酸性强弱:H2SiO3<H2CO3 | D. | 碱性强弱:NaOH>Mg(OH)2 |
11.某元素X的气态氢化物的化学式为XH3,则X的最高价氧化物的水化物的化学式为( )
| A. | H2XO3 | B. | HXO3 | C. | H2XO4 | D. | HXO4 |