题目内容
17. 如图装置是实验室里常见的气体发生装置,用该装置制取、提纯并收集表中的四种气体(a、b、c表示相应仪器中加入的试剂),其中可行的是( )
如图装置是实验室里常见的气体发生装置,用该装置制取、提纯并收集表中的四种气体(a、b、c表示相应仪器中加入的试剂),其中可行的是( )| 气体 | a | b | c | |
| A | NO2 | 浓硝酸 | 铜片 | NaOH溶液 |
| B | SO2 | 浓硫酸 | K2SO3粉末 | 浓硫酸 |
| C | NH3 | 浓氨水 | 生石灰 | 碱石灰 |
| D | CO2 | 稀硫酸 | CaCO3粉末 | NaOH溶液 |
| A. | A | B. | B | C. | C | D. | D |
分析 由实验装置图可知,该装置为液体与固体(或液体)在不加热条件下反应生成气体的制备装置,并且气体密度大于空气,用向上排空法收集,再进一步考虑选项中气体的净化是否合理,以此来解答.
解答 解:A.NO2与NaOH反应而被吸收,不能用NaOH溶液净化,故A错误;
B.浓硫酸与亚硫酸钾反应生成二氧化硫,浓硫酸干燥,利用向上排空气法收集,装置合理,故B正确;
C.氨气密度比空气小,不能用向上排空法收集,且碱石灰为固体,不能放在洗气瓶中,故C错误;
D.硫酸与碳酸钙在常温下发生反应反应硫酸钙微溶,阻止反应进行,且二氧化碳能被NaOH吸收不能净化二氧化碳,故D错误;
故选B.
点评 本题考查实验装置综合及常见气体的制备实验,为高频考点,把握常见物质的性质及气体的制备原理为解答的关键,侧重分析与实验能力的考查,题目难度不大.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
7.已知铁离子,氯气、溴均为常见的氧化剂,某化学兴趣小组设计了如下实验探究其强弱:
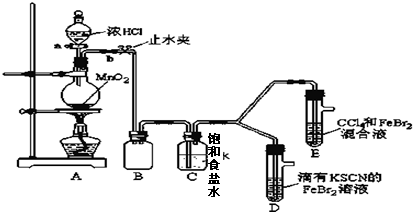
(1)①装置A中发生反应的离子方程式是MnO2+4H++2Cl-$\frac{\underline{\;△\;}}{\;}$Mn2++Cl2↑+2H2O.②整套实验装置存在一处明显的不足,请指出缺少尾气处理装置.
(2)用改正后的装置进行实验,实验过程如下:
(3)因忙于观察和记录,没有及时停止反应,D、E中均发生了新的变化.
D装置中:红色慢慢褪去.
E装置中:CCl4层颜色逐渐加深,直至变成红色.
为探究上述实验现象的本质,小组同学查得资料如下:
①请用平衡移动原理(结合上述资料)解释Cl2过量时D中溶液红色褪去的原因过量氯气和SCN-反应2SCN-+Cl2=2Cl-+(SCN)2,使SCN-浓度减小,则使Fe3++3SCN-?Fe(SCN)3平衡向逆反应方向移动而褪色.
现设计简单实验证明上述解释:取少量褪色后的溶液,滴加KSCN溶液溶液,若溶液颜色变红色.则上述解释是合理的.
小组同学另查得资料如下:
②欲探究E中颜色变化的原因,设计实验如下:用分液漏斗分离出E的下层溶液,蒸馏、收集红色物质,取少量,加入AgNO3溶液,结果观察到仅有白色沉淀产生.请结合上述资料用两步离子方程式解释仅产生白色沉淀原因BrCl+H2O=HBrO+H++Cl-、Ag++Cl-=AgCl↓.

(1)①装置A中发生反应的离子方程式是MnO2+4H++2Cl-$\frac{\underline{\;△\;}}{\;}$Mn2++Cl2↑+2H2O.②整套实验装置存在一处明显的不足,请指出缺少尾气处理装置.
(2)用改正后的装置进行实验,实验过程如下:
| 实验操作 | 实验现象 | 结论 |
| 打开活塞a,向圆底烧瓶中滴入适量浓盐酸;然后 关闭活塞a,点燃酒精灯. (填具体实验操作) | D装置中:溶液变红 E装置中:水层溶液变黄,振荡后,下层CCl4层无明显变化.一段时间后CCl4层由无色变为橙色.(填实验现象) | Cl2、Br2、Fe3+的氧化性由强到弱的顺序为: Cl2>Br2>Fe3+ |
D装置中:红色慢慢褪去.
E装置中:CCl4层颜色逐渐加深,直至变成红色.
为探究上述实验现象的本质,小组同学查得资料如下:
| ⅰ.Fe3++3SCN-?Fe(SCN)3 是一个可逆反应. ⅱ.(SCN)2性质与卤素单质类似.氧化性:Cl2>(SCN)2. |
现设计简单实验证明上述解释:取少量褪色后的溶液,滴加KSCN溶液溶液,若溶液颜色变红色.则上述解释是合理的.
小组同学另查得资料如下:
| ⅲ.Cl2和Br2反应生成BrCl,BrCl呈红色(略带黄色),沸点约5℃,它与水能发生水解反应,且该反应为非氧化还原反应. ⅳ.AgClO、AgBrO均可溶于水. |
5.锗和铝在周期表中位于对角线位置,两者性质很相似.下列关于锗和锗的化合物性质推断正确的是( )
| A. | 锗不能与强碱溶液反应 | B. | 氢氧化锗有两性 | ||
| C. | 氧化锗易溶于水 | D. | 氧化锗的化学式为Ge2O3 |
12.A、B、C、D、E是原子序数依次增大的短周期主族元素,A、D在周期表中的相对位置如右表;A元素最低负化合价的绝对值与其原子最外层电子数相等;C是地壳中含量最多的金属元素.
(1)A与氢元素组成的化合物分子有6个原子,其结构简式为CH2=CH2,写出该化合物在常温下使溴水褪色的化学方程式CH2=CH2+Br2→CH2Br-CH2Br,该化合物还是一种重要的化工原料,写出其加聚生成高分子的化学方程式:
(2)B元素的最高氧化物对应的水化物与它的氢化物反应得到离子化合物,则B元素的单质分子空间构型为直线形,写出该单质的一种等电子体:CO、CN-等
(3)C的离子结构示意图为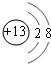 ,元素E在周期表中的位置是第3周期ⅦA族.
,元素E在周期表中的位置是第3周期ⅦA族.
| A | ||||
| D |

(2)B元素的最高氧化物对应的水化物与它的氢化物反应得到离子化合物,则B元素的单质分子空间构型为直线形,写出该单质的一种等电子体:CO、CN-等
(3)C的离子结构示意图为
 ,元素E在周期表中的位置是第3周期ⅦA族.
,元素E在周期表中的位置是第3周期ⅦA族.
2.下列关于能源和作为能源的物质的叙述中错误的是( )
| A. | 化石能源物质内部蕴储着大量的能量 | |
| B. | 绿色植物进行光合作用时,将太阳能转化为化学能“贮存”起来 | |
| C. | 物质的化学能可以在不同条件下转为热能、电能为人类所利用 | |
| D. | 我国经济发展要全部依靠化石能源 |
9.下列有关实验的做法或说法正确的是( )
| A. | 在制备乙烯的实验中,加热时应使温度缓慢上升至170°C | |
| B. | 在苯酚溶液中滴入少量稀溴水出现白色沉淀 | |
| C. | 将溴乙烷滴入NaOH溶液中,待充分反应再加入AgNO3溶液后有浅黄色沉淀生成 | |
| D. | 将铜丝在酒精灯上加热后,立即伸入无水乙醇中,铜丝恢复成原来的红色 |
6.锂电池是一代新型高能电池,它以质量轻、能量高而受到了普遍重视,目前已研制成功多种锂电池. 某种锂电池的总反应式是Li+MnO2=LiMnO2.下列说法正确的是( )
| A. | Li是负极,电极反应为Li+e-=Li+ | |
| B. | Li是正极,电极反应为Li+e-=Li- | |
| C. | MnO2是负极,电极反应为MnO2+e-=MnO2- | |
| D. | 锂电池是一种环保型电池 |
7.下表是元素周期表的一部分,针对表中的①~⑨种元素,填写下列空白:
(1)在这些元素中,化学性质最不活泼的是:Ar(填具体元素符号,下同).
(2)在最高价氧化物的水化物中,酸性最强的化合物的分子式是HClO4,
(3)写出⑤的最高价氧化物跟⑨的最高价氧化物的水化物在水溶液中反应的离子方程式Al2O3+2OH-═2AlO2-+H2O
(4)写出②最低价氢化物跟它的氧化物的水化物形成的所有化合物的化学式NH4NO3、NH4NO2,该化合物中含有的化学键有离子键和共价键.
| 主族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0族 |
| 2 | ① | ② | ③ | |||||
| 3 | ④ | ⑤ | ⑥ | ⑦ | ⑧ | |||
| 4 | ⑨ |
(2)在最高价氧化物的水化物中,酸性最强的化合物的分子式是HClO4,
(3)写出⑤的最高价氧化物跟⑨的最高价氧化物的水化物在水溶液中反应的离子方程式Al2O3+2OH-═2AlO2-+H2O
(4)写出②最低价氢化物跟它的氧化物的水化物形成的所有化合物的化学式NH4NO3、NH4NO2,该化合物中含有的化学键有离子键和共价键.
 如图表示的是在800℃时,含有A、B、C三种气体的体系中各物质浓度随时间变化的情况,请回答:
如图表示的是在800℃时,含有A、B、C三种气体的体系中各物质浓度随时间变化的情况,请回答: