题目内容
7.(1)Na2CO3的水溶液呈碱(填“酸”、“中”、“碱”,下同)性,常温时的pH>7(填“>”、“=”、“<”),原因是(用离子方程式表示):CO32-+H2O?HCO3-+OH-;(2)氯化铁水溶液常温时的pH<7(填“>”、“=”),原因是(用离子方程式表示)Fe3++3H2O?Fe(OH)3+3H+.把氯化铁溶液蒸干,灼烧,最后得到的主要固体产物化学式是Fe2O3.
(3)0.01mol/L 的NaHSO4溶液呈酸性,原因是(用电离方程式表示):NaHSO4=Na++H++SO42-,pH=2.
分析 (1)Na2CO3为强碱弱酸盐,CO3 2-水解:CO32-+H2O?HCO3-+OH-,使溶液呈碱性;
(2)FeCl3为强酸弱碱盐,Fe3+水解:Fe3++3H2O?Fe(OH)3+3H+,溶液呈酸性,氯化铁溶液蒸干,水解生成的氯化氢挥发,水解正向进行得到水解产物氢氧化铁,灼烧得到氧化铁;
(3)硫酸氢钠溶液中完全电离,溶液呈酸性,溶液pH=-lgc(H+)计算.
解答 解:(1)Na2CO3为强碱弱酸盐,CO3 2-离子水解:CO32-+H2O?HCO3-+OH-,使溶液呈碱性,pH<7,
故答案为:碱性;>; CO32-+H2O?HCO3-+OH-;
(2)FeCl3为强酸弱碱盐,Fe3+水解:Fe3++3H2O?Fe(OH)3+3H+,溶液呈酸性,PH<7,氯化铁溶液蒸干,水解生成的氯化氢挥发,水解正向进行得到水解产物氢氧化铁,灼烧得到氧化铁;
故答案为:<;Fe3++3H2O?Fe(OH)3+3H+;Fe2O3;
(3)0.01mol/L 的NaHSO4溶液中硫酸氢钠完全电离,溶液呈酸性,电离方程式为:NaHSO4=Na++H++SO42-,pH=-lg0.01=2,
故答案为:酸;NaHSO4=Na++H++SO42-;2.
点评 本题考查了盐类水解的原理分析判断,溶液酸碱性的实质分析,离子方程式书写方法,掌握基础是关键,题目难度中等.

练习册系列答案
相关题目
18.同周期的三种元素X、Y、Z,已知其最高价氧化物对应水化物的酸性强弱为HXO4>H2YO4>H3ZO4,则下列判断错误的是( )
| A. | 原子半径:X>Y>Z | B. | 气态氢化物的稳定性HX>H2Y>ZH3 | ||
| C. | 电负性:X>Y>Z | D. | 非金属性:X>Y>Z |
15.下列的氢氧化物中,碱性最强的是( )
| A. | Mg(OH)2 | B. | NaOH | C. | Al(OH)3 | D. | Si(OH)4 |
12.A、B、C、D、E是原子序数依次增大的短周期主族元素,A、D在周期表中的相对位置如右表;A元素最低负化合价的绝对值与其原子最外层电子数相等;C是地壳中含量最多的金属元素.
(1)A与氢元素组成的化合物分子有6个原子,其结构简式为CH2=CH2,写出该化合物在常温下使溴水褪色的化学方程式CH2=CH2+Br2→CH2Br-CH2Br,该化合物还是一种重要的化工原料,写出其加聚生成高分子的化学方程式:
(2)B元素的最高氧化物对应的水化物与它的氢化物反应得到离子化合物,则B元素的单质分子空间构型为直线形,写出该单质的一种等电子体:CO、CN-等
(3)C的离子结构示意图为 ,元素E在周期表中的位置是第3周期ⅦA族.
,元素E在周期表中的位置是第3周期ⅦA族.
| A | ||||
| D |

(2)B元素的最高氧化物对应的水化物与它的氢化物反应得到离子化合物,则B元素的单质分子空间构型为直线形,写出该单质的一种等电子体:CO、CN-等
(3)C的离子结构示意图为
 ,元素E在周期表中的位置是第3周期ⅦA族.
,元素E在周期表中的位置是第3周期ⅦA族.
19.下列说法正确的是( )
| A. | 分子间作用力与化学键的键能大小相当 | |
| B. | 分子间作用力远强于化学键,是一种很强的作用 | |
| C. | 氢键主要影响物质的化学性质 | |
| D. | 分子内部的相邻原子之间强烈的相互作用称为化学键,而分子之间存在的相互作用称为分子间作用力 |
16.可用于区别苯酚、乙醇、氢氧化钠、硝酸银、硫氰化钾五种溶液的一种试剂是( )
| A. | FeCl3溶液 | B. | 石蕊试液 | C. | 浓溴水 | D. | FeCl2溶液 |


 ; F
; F  ;
;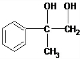 +O2$→_{△}^{Cu}$2
+O2$→_{△}^{Cu}$2 +2H2O;
+2H2O;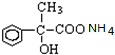 +2Ag↓+3NH3+H2O.
+2Ag↓+3NH3+H2O. 用纯净的碳酸钙跟稀盐酸反应制取二氧化碳气体.请回答问题:
用纯净的碳酸钙跟稀盐酸反应制取二氧化碳气体.请回答问题: