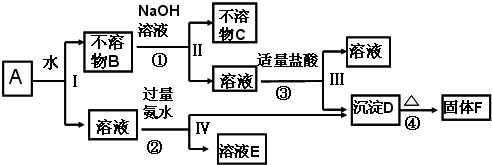
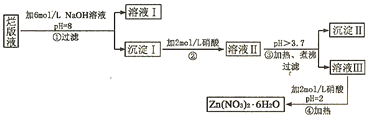
题目内容
2.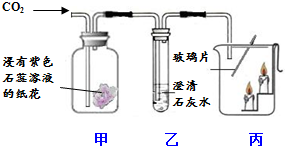 利用如图装置,验证CO2的性质.
利用如图装置,验证CO2的性质.(1)甲中的现象是纸花颜色由紫变红.
(2)乙中发生反应的化学方程式为CO2+Ca(OH)2═CaCO3↓+H2O.
(3)丙中下方蜡烛先熄灭上方蜡烛后熄灭,此现象证明二氧化碳具有的性质密度大于空气、不燃烧也不支持燃烧.
分析 (1)二氧化碳为酸性氧化物,能够使紫色石蕊试液变红;
(2)二氧化碳与氢氧化钙反应生成碳酸钙沉淀,澄清石灰水变浑浊,据此写出反应的化学方程式;
(3)蜡烛熄灭,证明二氧化碳不支持燃烧;下方蜡烛先熄灭证明二氧化碳的密度比空气密度大.
解答 解:(1)二氧化碳为酸性氧化物,溶于水生成弱酸碳酸,水溶液显示酸性,所以甲中浸有紫色石蕊试液的纸花颜色由紫变红,
故答案为:纸花颜色由紫变红;
(2)二氧化碳与澄清石灰水反应生成碳酸钙沉淀和水,所以乙装置中澄清石灰水会变浑浊,反应的化学方程式为:CO2+Ca(OH)2═CaCO3↓+H2O,
故答案为:CO2+Ca(OH)2═CaCO3↓+H2O;
(3)丙中下方蜡烛先熄灭上方蜡烛后熄灭:蜡烛熄灭,证明二氧化碳不支持燃烧,丙中下方的蜡烛先熄灭,证明二氧化碳的密度大于空气,
故答案为:密度大于空气、不燃烧也不支持燃烧.
点评 本题考查了性质实验方案的设计,题目难度中等,明确二氧化碳的性质及检验方法为解答关键,注意掌握性质实验方案设计的原则,试题培养了学生的分析、理解能力及化学实验能力.

练习册系列答案
相关题目
3.国际化学年是以纪念化学学科所取得的成就以及对人类文明的贡献.下列关于生产、生活和能源中的化学知识的说法不正确的是( )
| A. | 该图表示的是“节能减排”中的节能标志 | |
| B. | 加快化石燃料的开采与使用,停止使用核能 | |
| C. | 安装煤炭“固硫”、“脱硝”装置,降低酸雨发生率 | |
| D. | 推广农作物的生物防治技术,减少农药的使用 |
13. 某烧碱溶液中含有少量杂质(不与盐酸反应),现用中和滴定测定其浓度.
某烧碱溶液中含有少量杂质(不与盐酸反应),现用中和滴定测定其浓度.
(1)滴定:①用酸式滴定管盛装1.00mol/L盐酸标准液.如图表示某次滴定时50mL滴定管中前后液面的位置.请将用去的标准盐酸的体积填入③表空格中.滴定管中剩余液体的体积大于.0.10mL(填大于、小于或者等于).
②下表是3种常见指示剂的变色范围:
该实验不可选用石蕊作指示剂;若使用酚酞做指示剂滴定终点为滴入最后一滴,溶液由浅红色变为无色,且半分钟内不恢复
③有关数据记录如下:
(2)根据所给数据,计算出烧碱样品中NaOH的物质的量浓度1.23mol/L
(3)下列几种情况会使测定结果偏高的是ce
a.若滴定前用蒸馏水冲洗锥形瓶;
b.滴定后俯视读数;
c.若在滴定过程中不慎将数滴酸液滴在锥形瓶外;
d.若未充分振荡,刚看到溶液变色,立刻停止滴定.
e.未用标准液润洗酸式滴定管.
 某烧碱溶液中含有少量杂质(不与盐酸反应),现用中和滴定测定其浓度.
某烧碱溶液中含有少量杂质(不与盐酸反应),现用中和滴定测定其浓度.(1)滴定:①用酸式滴定管盛装1.00mol/L盐酸标准液.如图表示某次滴定时50mL滴定管中前后液面的位置.请将用去的标准盐酸的体积填入③表空格中.滴定管中剩余液体的体积大于.0.10mL(填大于、小于或者等于).
②下表是3种常见指示剂的变色范围:
| 指示剂 | 石蕊 | 甲基橙 | 酚酞 |
| 变色范围(pH) | 5.0-8.0 | 3.1-4.4 | 8.2-10.0 |
③有关数据记录如下:
| 滴定序号 | 待测液体积(mL) | 所消耗盐酸标准液的体积(mL) | ||
| 滴定前 | 滴定后 | 消耗的体积 | ||
| 1 | 20 | 0.50 | 25.12 | 24.62 |
| 2 | 20 | 如图 | 如图 | 填写24.60 |
| 3 | 20 | 6.00 | 30.58 | 24.58 |
(3)下列几种情况会使测定结果偏高的是ce
a.若滴定前用蒸馏水冲洗锥形瓶;
b.滴定后俯视读数;
c.若在滴定过程中不慎将数滴酸液滴在锥形瓶外;
d.若未充分振荡,刚看到溶液变色,立刻停止滴定.
e.未用标准液润洗酸式滴定管.
7.已知铁离子,氯气、溴均为常见的氧化剂,某化学兴趣小组设计了如下实验探究其强弱:
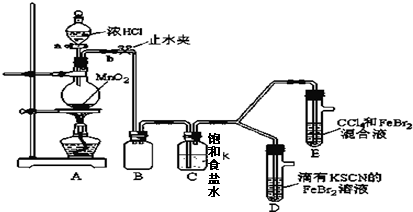
(1)①装置A中发生反应的离子方程式是MnO2+4H++2Cl-$\frac{\underline{\;△\;}}{\;}$Mn2++Cl2↑+2H2O.②整套实验装置存在一处明显的不足,请指出缺少尾气处理装置.
(2)用改正后的装置进行实验,实验过程如下:
(3)因忙于观察和记录,没有及时停止反应,D、E中均发生了新的变化.
D装置中:红色慢慢褪去.
E装置中:CCl4层颜色逐渐加深,直至变成红色.
为探究上述实验现象的本质,小组同学查得资料如下:
①请用平衡移动原理(结合上述资料)解释Cl2过量时D中溶液红色褪去的原因过量氯气和SCN-反应2SCN-+Cl2=2Cl-+(SCN)2,使SCN-浓度减小,则使Fe3++3SCN-?Fe(SCN)3平衡向逆反应方向移动而褪色.
现设计简单实验证明上述解释:取少量褪色后的溶液,滴加KSCN溶液溶液,若溶液颜色变红色.则上述解释是合理的.
小组同学另查得资料如下:
②欲探究E中颜色变化的原因,设计实验如下:用分液漏斗分离出E的下层溶液,蒸馏、收集红色物质,取少量,加入AgNO3溶液,结果观察到仅有白色沉淀产生.请结合上述资料用两步离子方程式解释仅产生白色沉淀原因BrCl+H2O=HBrO+H++Cl-、Ag++Cl-=AgCl↓.

(1)①装置A中发生反应的离子方程式是MnO2+4H++2Cl-$\frac{\underline{\;△\;}}{\;}$Mn2++Cl2↑+2H2O.②整套实验装置存在一处明显的不足,请指出缺少尾气处理装置.
(2)用改正后的装置进行实验,实验过程如下:
| 实验操作 | 实验现象 | 结论 |
| 打开活塞a,向圆底烧瓶中滴入适量浓盐酸;然后 关闭活塞a,点燃酒精灯. (填具体实验操作) | D装置中:溶液变红 E装置中:水层溶液变黄,振荡后,下层CCl4层无明显变化.一段时间后CCl4层由无色变为橙色.(填实验现象) | Cl2、Br2、Fe3+的氧化性由强到弱的顺序为: Cl2>Br2>Fe3+ |
D装置中:红色慢慢褪去.
E装置中:CCl4层颜色逐渐加深,直至变成红色.
为探究上述实验现象的本质,小组同学查得资料如下:
| ⅰ.Fe3++3SCN-?Fe(SCN)3 是一个可逆反应. ⅱ.(SCN)2性质与卤素单质类似.氧化性:Cl2>(SCN)2. |
现设计简单实验证明上述解释:取少量褪色后的溶液,滴加KSCN溶液溶液,若溶液颜色变红色.则上述解释是合理的.
小组同学另查得资料如下:
| ⅲ.Cl2和Br2反应生成BrCl,BrCl呈红色(略带黄色),沸点约5℃,它与水能发生水解反应,且该反应为非氧化还原反应. ⅳ.AgClO、AgBrO均可溶于水. |
14.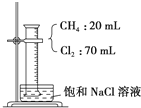 如图,在光照条件下,将盛有CH4和Cl2的量筒倒扣于盛有饱和食盐水的水槽中进行实验,对实验现象及产物分析中错误的是 ( )
如图,在光照条件下,将盛有CH4和Cl2的量筒倒扣于盛有饱和食盐水的水槽中进行实验,对实验现象及产物分析中错误的是 ( )
 如图,在光照条件下,将盛有CH4和Cl2的量筒倒扣于盛有饱和食盐水的水槽中进行实验,对实验现象及产物分析中错误的是 ( )
如图,在光照条件下,将盛有CH4和Cl2的量筒倒扣于盛有饱和食盐水的水槽中进行实验,对实验现象及产物分析中错误的是 ( )| A. | 混合气体的颜色变浅,量筒中液面上升 | |
| B. | 量筒内壁上出现的油状液滴,应只是三氯甲烷、四氯甲烷的混合物 | |
| C. | 已知HCl可降低NaCl的溶解度,故水槽中有固体物质析出 | |
| D. | 甲烷与氯气反应后的产物只有CCl4 |
11.下列有关叙述正确的是( )
| A. | 两原子之间形成共价键时,可形成2个σ键 | |
| B. | 将铁制品做炊具,金属键没有被破坏 | |
| C. | 温度越高,金属的导电性越好 | |
| D. | 任何晶体都含化学键. |
12.A、B、C、D、E是原子序数依次增大的短周期主族元素,A、D在周期表中的相对位置如右表;A元素最低负化合价的绝对值与其原子最外层电子数相等;C是地壳中含量最多的金属元素.
(1)A与氢元素组成的化合物分子有6个原子,其结构简式为CH2=CH2,写出该化合物在常温下使溴水褪色的化学方程式CH2=CH2+Br2→CH2Br-CH2Br,该化合物还是一种重要的化工原料,写出其加聚生成高分子的化学方程式:
(2)B元素的最高氧化物对应的水化物与它的氢化物反应得到离子化合物,则B元素的单质分子空间构型为直线形,写出该单质的一种等电子体:CO、CN-等
(3)C的离子结构示意图为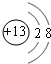 ,元素E在周期表中的位置是第3周期ⅦA族.
,元素E在周期表中的位置是第3周期ⅦA族.
| A | ||||
| D |

(2)B元素的最高氧化物对应的水化物与它的氢化物反应得到离子化合物,则B元素的单质分子空间构型为直线形,写出该单质的一种等电子体:CO、CN-等
(3)C的离子结构示意图为
 ,元素E在周期表中的位置是第3周期ⅦA族.
,元素E在周期表中的位置是第3周期ⅦA族.