题目内容
20.将煤焦油中的苯、甲苯与苯酚进行分离,可采取以如图示方法及操作.
(1)写出物质①和⑤的化学式:①NaOH,⑤CO2.
(2)写出分离方法②和③的名称:②分液,③分馏.
(3)混合物中加入溶液①反应的化学方程式为
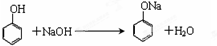 .
.(4)下层液体④通人气体⑤反应的化学方程式为
 .
.(5)分离出的苯酚含在(用编号回答)⑥中.
分析 混合物加入溶液①,经过方法②得到互不相溶的溶液,应为分液操作,甲苯、苯和氢氧化钠不反应,苯酚具有酸性能和氢氧化钠反应生成可溶性的苯酚钠,转移到下层溶液中,故溶液①为NaOH溶液,方法③为分离互溶的液体,应是分馏操作,苯酚的酸性比碳酸还弱,苯酚钠能和二氧化碳、水反应生成苯酚,故气体⑤为二氧化碳.
解答 解:混合物加入溶液①,经过方法②得到互不相溶的溶液,应为分液操作,甲苯、苯和氢氧化钠不反应,苯酚具有酸性能和氢氧化钠反应生成可溶性的苯酚钠,转移到下层溶液中,故溶液①为NaOH溶液,方法③为分离互溶的液体,应是分馏操作,苯酚的酸性比碳酸还弱,苯酚钠能和二氧化碳、水反应生成苯酚,故气体⑤为二氧化碳.
(1)由上述分析可知,①为NaOH,⑤为CO2,故答案为:NaOH;CO2;
(2)方法②是将互不相溶的液体分离,采用分液的方法,方法③是将互溶的液体分离,采用分馏的方法分离,故答案为:分液;分馏;
(3)苯酚能和氢氧化钠反应生成苯酚钠和水,反应方程式为 ,故答案为:
,故答案为: ;
;
(4)苯酚钠能和二氧化碳、水反应生成苯酚和碳酸氢钠,反应方程式为 ,故答案为:
,故答案为: ;
;
(5)溶液④与二氧化碳反应得到苯酚,故分离的苯酚在⑥中,故答案为:⑥.
点评 本题考查物质的分离提纯、苯酚的性质等,难度不大,注意苯酚钠和二氧化碳、水反应生成碳酸氢钠和苯酚,为易错点.

练习册系列答案
 愉快的寒假南京出版社系列答案
愉快的寒假南京出版社系列答案
相关题目
11.下列有关叙述正确的是( )
| A. | 两原子之间形成共价键时,可形成2个σ键 | |
| B. | 将铁制品做炊具,金属键没有被破坏 | |
| C. | 温度越高,金属的导电性越好 | |
| D. | 任何晶体都含化学键. |
15.下列的氢氧化物中,碱性最强的是( )
| A. | Mg(OH)2 | B. | NaOH | C. | Al(OH)3 | D. | Si(OH)4 |
5.锗和铝在周期表中位于对角线位置,两者性质很相似.下列关于锗和锗的化合物性质推断正确的是( )
| A. | 锗不能与强碱溶液反应 | B. | 氢氧化锗有两性 | ||
| C. | 氧化锗易溶于水 | D. | 氧化锗的化学式为Ge2O3 |
12.A、B、C、D、E是原子序数依次增大的短周期主族元素,A、D在周期表中的相对位置如右表;A元素最低负化合价的绝对值与其原子最外层电子数相等;C是地壳中含量最多的金属元素.
(1)A与氢元素组成的化合物分子有6个原子,其结构简式为CH2=CH2,写出该化合物在常温下使溴水褪色的化学方程式CH2=CH2+Br2→CH2Br-CH2Br,该化合物还是一种重要的化工原料,写出其加聚生成高分子的化学方程式:
(2)B元素的最高氧化物对应的水化物与它的氢化物反应得到离子化合物,则B元素的单质分子空间构型为直线形,写出该单质的一种等电子体:CO、CN-等
(3)C的离子结构示意图为 ,元素E在周期表中的位置是第3周期ⅦA族.
,元素E在周期表中的位置是第3周期ⅦA族.
| A | ||||
| D |

(2)B元素的最高氧化物对应的水化物与它的氢化物反应得到离子化合物,则B元素的单质分子空间构型为直线形,写出该单质的一种等电子体:CO、CN-等
(3)C的离子结构示意图为
 ,元素E在周期表中的位置是第3周期ⅦA族.
,元素E在周期表中的位置是第3周期ⅦA族.
9.下列有关实验的做法或说法正确的是( )
| A. | 在制备乙烯的实验中,加热时应使温度缓慢上升至170°C | |
| B. | 在苯酚溶液中滴入少量稀溴水出现白色沉淀 | |
| C. | 将溴乙烷滴入NaOH溶液中,待充分反应再加入AgNO3溶液后有浅黄色沉淀生成 | |
| D. | 将铜丝在酒精灯上加热后,立即伸入无水乙醇中,铜丝恢复成原来的红色 |
10.下列各组顺序的排列不正确的是( )
| A. | 原子半径:Na<Mg | B. | 热稳定性:HCl>H2S | ||
| C. | 酸性强弱:H2SiO3<H2CO3 | D. | 碱性强弱:NaOH>Mg(OH)2 |

 如图表示的是在800℃时,含有A、B、C三种气体的体系中各物质浓度随时间变化的情况,请回答:
如图表示的是在800℃时,含有A、B、C三种气体的体系中各物质浓度随时间变化的情况,请回答: