题目内容
【题目】在密闭容器中发生:![]() ,已知:c(CO2)随温度(T)、时间(t)的变化曲线如图所示,则:
,已知:c(CO2)随温度(T)、时间(t)的变化曲线如图所示,则:
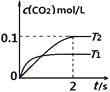
(1)T1____________T2 , 其理由是____________
(2)在T2温度下,0~2s内的平均反应速率v(N2)=____________
(3)下列叙述中能判断该反应达平衡状态的是____________
A. 平衡体系中气体压强不再改变 B. 平衡体系中气体密度不再改变
C. c(CO2):c(N2)=2:1 D. V正(CO):V逆(N2)=2:1
(4)若容器恒容,绝热,加热使容器内温度迅速升至原来的2倍,达到新平衡后,容器内温度________(填“大于”“小于”或“等于”)原来的2倍。
(5)在温度T3下,在两个体积均为1.0L的恒容密闭容器中发生该反应.
容器编号 | 起始物质的量 | 平衡时物质的量 |
Ⅰ | 2.0molNO,2.0molCO | 1.0molCO2 |
Ⅱ | 4.0molNO,4.0molCO |
①T3时该反应的平衡常数K=_________,若起始时向容器Ⅰ中充入1.0mol NO,1.5mol CO和2.0molCO2, 0.5molN2, 则反应向_________(填“正”或“逆”)反应方向进行。
②平衡时两容器中CO的转化率:Ⅰ_________Ⅱ,容器Ⅰ中反应达平衡后,若要进一步提高CO的转化率,可采取的措施为(请写出两条)_________________ __________________。
【答案】> 因为T1温度下先达到平衡,说明反应速率快,温度高 0.025mol/(Ls) AD 小于 0.5 正 < 增加NO量 降低温度或增大外部压强或缩小容器容积(写出其中两条)
【解析】
(1)根据图象中“先拐先平数值大”判断;
(2)根据化学反应速率的公式![]() 计算求出二氧化碳表示的反应速率,再利用化学计量数之比得出结论;
计算求出二氧化碳表示的反应速率,再利用化学计量数之比得出结论;
(3)反应到达平衡状态时,正逆反应速率相等,平衡时各物质的浓度、百分含量不变,可以及由此衍生的一些量也不发生变化,由此进行判断;
(4)根据勒夏特列原理解答;
(5)①根据表格信息,列出三段式结合平衡常数表达式进行求解;
②容器Ⅱ与容器Ⅰ对比,相当于加压,根据外因对平衡的影响效果分析作答。
(1)根据图象可以看出,在T1温度下反应先达到平衡,说明该温度下反应速率快,对应的温度高,则T1>T2,故答案为:>;因为T1温度下先达到平衡,说明反应速率快,温度高;
(2)从图中可看出0~2s内的平均反应速率v(CO2)=![]() =0.05 mol/(Ls),化学反应速率之比等于参加反应各物质的化学计量数之比,则v(N2)=
=0.05 mol/(Ls),化学反应速率之比等于参加反应各物质的化学计量数之比,则v(N2)=![]() v(CO2)= 0.025mol/(Ls);
v(CO2)= 0.025mol/(Ls);
(3)反应![]() 是气体体积减小的放热反应,则
是气体体积减小的放热反应,则
A. 恒容条件下,平衡体系中气体压强之比等于气体的物质的量之比,气体的压强不再改变,则说明反应达到平衡状态,A项正确;
B. 平衡体系中气体密度等于气体的总质量与容器的体积之比,因气体的总质量始终不变,故气体的密度不再改变,不能说明反应达到平衡状态,B项错误;
C. c(CO2):c(N2)=2:1,反应不一定达到平衡,C项错误;
D. V(CO):V(N2)的比值始终等于化学计量数之比,又V正(CO):V逆(N2)=2:1,表示的是V正= V逆,故能说明反应达到平衡状态,D项正确;
故答案为AD;
(4)若容器恒容、绝热,加热使容器内温度迅速升至原来的2倍,根据勒夏特列原理,平衡向吸热反应的方向移动,即逆向移动,达新平衡后,容器内温度大于原来的温度,小于原来温度的2倍,故答案为:小于;
(5)①起始加入2.0molNO,2.0molCO,平衡时生成1.0molCO2,则
![]()
起始量(mol/L)2.0 2.0 0 0
变化量(mol/L)1.0 1.0 1.0 0.5
平衡量(mol/L)1.0 1.0 1.0 0.5
则化学平衡常数K=![]() =0.5;
=0.5;
若起始时向容器Ⅰ中充入1.0mol NO,1.5mol CO和2.0molCO2, 0.5molN2,则各物质的浓度分别为:2.0mol/L NO,2.5mol/L CO和3.0mol/LCO2,1mol/L N2,Qc=![]() =0.36<K,反应未达到平衡,反应向正反应方向进行,故答案为:0.5;正;
=0.36<K,反应未达到平衡,反应向正反应方向进行,故答案为:0.5;正;
②反应![]() 是气体体积减小的放热反应,容器Ⅱ与容器Ⅰ对比,相当于增大体系的压强,则平衡向正反应方向移动,故平衡时两容器中CO的转化率:Ⅰ<Ⅱ;根据列夏特勒原理可知,容器Ⅰ中反应达平衡后,若要进一步提高CO的转化率,使反应向正方向移动,则可增加NO量、降低温度或增大外部压强或缩小容器容积(写出其中两条)
是气体体积减小的放热反应,容器Ⅱ与容器Ⅰ对比,相当于增大体系的压强,则平衡向正反应方向移动,故平衡时两容器中CO的转化率:Ⅰ<Ⅱ;根据列夏特勒原理可知,容器Ⅰ中反应达平衡后,若要进一步提高CO的转化率,使反应向正方向移动,则可增加NO量、降低温度或增大外部压强或缩小容器容积(写出其中两条)
故答案为:<;增加NO量、降低温度或增大外部压强或缩小容器容积(写出其中两条)。

 培优好卷单元加期末卷系列答案
培优好卷单元加期末卷系列答案 一线名师权威作业本系列答案
一线名师权威作业本系列答案【题目】在1L恒容密闭容器中充入X(g)和Y(g),发生反应X(g)+Y(g)![]() M(g)+N(g),所得实验数据如下表:
M(g)+N(g),所得实验数据如下表:
实验编号 | 温度/℃ | 起始时物质的量/mol | 平衡时物质的量/mol | |
n(X) | n(Y) | n(M) | ||
① | 700 | 0.10 | 0.10 | 0.09 |
② | 800 | 0.20 | 0.20 | 0.10 |
③ | 800 | 0.20 | 0. 30 | a |
④ | 900 | 0.10 | 0.15 | b |
下列说法错误的是
A. 实验①中,若5min时测得n(M) =0.05mol,则0至5min时间内,用N表示的平均反应速率v(N) =0.01 mol/( L·min)
B. 实验②中,该反应的平衡常数K= 1.0
C. 实验③中,达到平衡时,X的转化率为60%
D. 实验④中,达到平衡时,b>0.06
【题目】已知:下表为25℃时某些弱酸的电离平衡常数。
CH3COOH | HClO | H2CO3 |
Ka=1.8×10﹣5 | Ka=3.0×10﹣8 | Ka1=4.4×10﹣7Ka2=4.7×10﹣11 |
如图表示常温下,稀释CH3COOH、HClO两种酸的稀溶液时,溶液pH随加水量的变化.下列说法正确的是( )

A.Ⅰ曲线代表HClO,Ⅱ曲线代表CH3COOH
B.向NaClO溶液中通入少量二氧化碳的离子方程式为:ClO﹣+CO2+H2O=HClO+CO32-
C.图象中a、c两点处的溶液中![]() 相等(HR代表CH3COOH或HClO)
相等(HR代表CH3COOH或HClO)
D.图象中a点酸的总浓度大于b点酸的总浓度
【题目】已知:在室温下有以下平衡:
编号 | 平衡方程式 | 平衡常数 |
① | HCNH++CN- | Ka=1×10-10 |
② | H2OH++OH- | Kw=1×10-14 |
③ | CN-+H2OHCN+OH- | K=? |
则下列判断错误的是
A.①的ΔS>0, ΔH>0
B.用标准NaOH溶液滴定浓度约为0.01molL-1HCN,可用甲基橙做指示剂
C.0.2molL-1的HCN溶液中加入等体积的0.1molL-1NaOH溶液,则该溶液呈碱性
D.0.2molL-1的HCN溶液中加入等体积的0.1molL-1NaOH所得的混合溶液中:2c(H+)+c(HCN)=2c(OH-)+c(CN-)
【题目】(I)已知在448 ℃时,反应H2(g)+I2(g)![]() 2HI(g)的平衡常数K1为49,则该温度下反应2HI(g)
2HI(g)的平衡常数K1为49,则该温度下反应2HI(g)![]() H2(g)+I2(g)的平衡常数K2为______;反应
H2(g)+I2(g)的平衡常数K2为______;反应![]() H2(g)+
H2(g)+![]() I2(g)
I2(g)![]() HI(g)的平衡常数K3为________。
HI(g)的平衡常数K3为________。
(II)在一定体积的密闭容器中进行化学反应:CO2(g)+H2(g)![]() CO(g)+H2O(g),其化学平衡常数和温度的关系如下表所示:
CO(g)+H2O(g),其化学平衡常数和温度的关系如下表所示:
t/℃ | 700 | 800 | 830 | 1 000 | 1 200 |
K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
回答下列问题:
(1)该反应的化学平衡常数表达式为K=_____。
(2)该反应为_____(填“吸热”或“放热”)反应。
(3)某温度下,平衡浓度符合下式:c(CO2)·c(H2)=c(CO)·c(H2O),试判断此时的温度为_____℃。
(4)在800℃时,发生上述反应,某一时刻测得容器内各物质的浓度分别为c(CO2)=2mol·L1,c(H2)=1.5mol·L1,c(CO)=1mol·L1,c(H2O)=3mol·L1,则下一时刻,反应向_____(填“正向”或“逆向”)进行。