题目内容
【题目】已知:在室温下有以下平衡:
编号 | 平衡方程式 | 平衡常数 |
① | HCNH++CN- | Ka=1×10-10 |
② | H2OH++OH- | Kw=1×10-14 |
③ | CN-+H2OHCN+OH- | K=? |
则下列判断错误的是
A.①的ΔS>0, ΔH>0
B.用标准NaOH溶液滴定浓度约为0.01molL-1HCN,可用甲基橙做指示剂
C.0.2molL-1的HCN溶液中加入等体积的0.1molL-1NaOH溶液,则该溶液呈碱性
D.0.2molL-1的HCN溶液中加入等体积的0.1molL-1NaOH所得的混合溶液中:2c(H+)+c(HCN)=2c(OH-)+c(CN-)
【答案】B
【解析】
A.弱电解质的电离过程是吸热过程,则HCNH++CN-的ΔS>0、ΔH>0,故A正确;
B.用标准NaOH溶液滴定浓度约为0.01molL-1HCN,完全中和时生成NaCN,溶液显碱性,则应选择酚酞做指示剂,故B错误;
C.0.2molL-1的HCN溶液中加入等体积的0.1molL-1NaOH溶液,溶液中溶质HCN和NaCN等物质的量,因CN-的水解常数Kh=![]() =
=![]() >Ka,说明溶液中CN-的水解程度大于HCN的电离程度,即该溶液呈碱性,故C正确;
>Ka,说明溶液中CN-的水解程度大于HCN的电离程度,即该溶液呈碱性,故C正确;
D.0.2molL-1的HCN溶液中加入等体积的0.1molL-1NaOH溶液,溶液中溶质HCN和NaCN等物质的量,溶液中的电荷守恒式为c(H+)+c(Na+)=c(OH-)+c(CN-),物料守恒式为2c(Na+)=c(HCN)+c(CN-),则2c(H+)+c(HCN)=2c(OH-)+c(CN-),故D正确;
故答案为B。

【题目】在密闭容器中发生:![]() ,已知:c(CO2)随温度(T)、时间(t)的变化曲线如图所示,则:
,已知:c(CO2)随温度(T)、时间(t)的变化曲线如图所示,则:
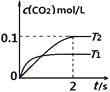
(1)T1____________T2 , 其理由是____________
(2)在T2温度下,0~2s内的平均反应速率v(N2)=____________
(3)下列叙述中能判断该反应达平衡状态的是____________
A. 平衡体系中气体压强不再改变 B. 平衡体系中气体密度不再改变
C. c(CO2):c(N2)=2:1 D. V正(CO):V逆(N2)=2:1
(4)若容器恒容,绝热,加热使容器内温度迅速升至原来的2倍,达到新平衡后,容器内温度________(填“大于”“小于”或“等于”)原来的2倍。
(5)在温度T3下,在两个体积均为1.0L的恒容密闭容器中发生该反应.
容器编号 | 起始物质的量 | 平衡时物质的量 |
Ⅰ | 2.0molNO,2.0molCO | 1.0molCO2 |
Ⅱ | 4.0molNO,4.0molCO |
①T3时该反应的平衡常数K=_________,若起始时向容器Ⅰ中充入1.0mol NO,1.5mol CO和2.0molCO2, 0.5molN2, 则反应向_________(填“正”或“逆”)反应方向进行。
②平衡时两容器中CO的转化率:Ⅰ_________Ⅱ,容器Ⅰ中反应达平衡后,若要进一步提高CO的转化率,可采取的措施为(请写出两条)_________________ __________________。