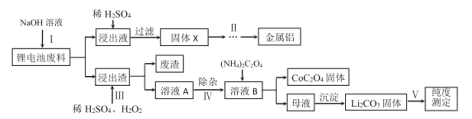
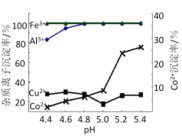
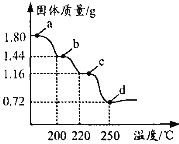
题目内容
【题目】某校化学研究性学习小组欲设计实验验证Fe、Cu的金属活动性,他们提出了以下两种方案。请你帮助他们完成有关实验项目。
(1)方案Ⅰ:有人提出将大小相等的铁片和铜片同时放入稀硫酸(或稀盐酸)中,观察产生气泡的快慢,据此确定它们的活动性。该原理的离子方程式为_________________________。
(2)方案Ⅱ:有人利用Fe、Cu作电极设计成原电池,以确定它们的活动性。试在下面的方框内画出原电池装置图,标出原电池的电极材料和电解质溶液,并写出电极反应式______________________________________。
(3)方案Ⅲ:结合你所学的知识,帮助他们再设计一个验证Fe、Cu活动性的简单实验方案(与方案Ⅰ、Ⅱ不能雷同):_________________________________________________;用离子方程式表示其反应原理:_______________________________________________。
【答案】Fe+2H+===Fe2++H2↑  正极反应:2H++2e-===H2↑;负极反应:Fe-2e-===Fe2+ 把铁片插入CuSO4溶液中,一段时间后,观察铁片表面是否生成红色物质 Fe+Cu2+===Fe2++Cu
正极反应:2H++2e-===H2↑;负极反应:Fe-2e-===Fe2+ 把铁片插入CuSO4溶液中,一段时间后,观察铁片表面是否生成红色物质 Fe+Cu2+===Fe2++Cu
【解析】
(1)方案Ⅰ:根据铁与酸的反应分析并写出离子方程式;
(2)方案Ⅱ:根据正负极上得失电子写出电极反应式;
(3)方案Ⅲ:根据铁、铜之间的置换反应设计。
(1)方案Ⅰ:金属的活动性越强,与酸反应越剧烈,产生H2的速率越快,Fe能与H+反应生成H2:Fe+2H+===Fe2++H2↑,Cu不与H+反应,无明显现象,所以Fe的活动性大于Cu的。
(2)方案Ⅱ:利用原电池中相对活泼金属失去电子为原电池负极,相对不活泼的金属为原电池的正极来判断金属活动性的相对强弱,正极上氢离子得电子生成氢气,反应还原反应,电极反应式为2H++2e===H2↑;负极上铁失电子生成二价铁离子,发生氧化反应,电极反应式为Fe2e===Fe2+;用铁、铜作电极,稀硫酸作电解质溶液设计原电池,铁的金属性比铜强,所以铁作负极,铜作正极,电子从负极沿导线流向正极: ;
;
(3)方案Ⅲ:可根据活动性强的金属能将活动性弱的金属从其盐溶液中置换出来设计实验,设计方法如下:将铁片置于CuSO4溶液中,一段时间后观察Fe表面有红色的金属铜析出,即可以证明金属铁的活泼性强于金属铜的;反应原理为:铁和铜离子发生氧化还原反应生成铜和二价铁离子,反应的离子方程式为:Fe+Cu2+═Fe2++Cu。

【题目】在密闭容器中发生:![]() ,已知:c(CO2)随温度(T)、时间(t)的变化曲线如图所示,则:
,已知:c(CO2)随温度(T)、时间(t)的变化曲线如图所示,则:
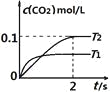
(1)T1____________T2 , 其理由是____________
(2)在T2温度下,0~2s内的平均反应速率v(N2)=____________
(3)下列叙述中能判断该反应达平衡状态的是____________
A. 平衡体系中气体压强不再改变 B. 平衡体系中气体密度不再改变
C. c(CO2):c(N2)=2:1 D. V正(CO):V逆(N2)=2:1
(4)若容器恒容,绝热,加热使容器内温度迅速升至原来的2倍,达到新平衡后,容器内温度________(填“大于”“小于”或“等于”)原来的2倍。
(5)在温度T3下,在两个体积均为1.0L的恒容密闭容器中发生该反应.
容器编号 | 起始物质的量 | 平衡时物质的量 |
Ⅰ | 2.0molNO,2.0molCO | 1.0molCO2 |
Ⅱ | 4.0molNO,4.0molCO |
①T3时该反应的平衡常数K=_________,若起始时向容器Ⅰ中充入1.0mol NO,1.5mol CO和2.0molCO2, 0.5molN2, 则反应向_________(填“正”或“逆”)反应方向进行。
②平衡时两容器中CO的转化率:Ⅰ_________Ⅱ,容器Ⅰ中反应达平衡后,若要进一步提高CO的转化率,可采取的措施为(请写出两条)_________________ __________________。