题目内容
【题目】常温下 0.1mol/L的H2A溶液中H2A、HA-、A2-在三者中所占物质的量分数(分布系数)随pH变化的关系如图所示。回答下列问题:
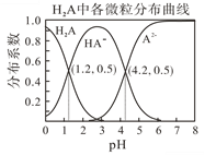
(1)H2A的电离方程式是__________________,二级电离常数K2=_________。
(2)已知25℃时HF的Ka=10-3.45,将少量H2A的溶液加入足量NaF溶液中,发生反应的离子方程式为_______________________。
【答案】H2A![]() H++HA- 10-4.2 H2A+F-==HF+HA-
H++HA- 10-4.2 H2A+F-==HF+HA-
【解析】
⑴多元弱酸的电离是一步一步电离,从图中pH=4.2分析二级电离常数。
⑵根据图中pH = 1.2信息得出一级电离常数,根据电离常数得出酸强弱顺序,再根据酸强弱书写离子方程式。
⑴多元弱酸的电离是一步一步电离,H2A的电离方程式是H2A![]() H++HA-,从图中pH=4.2分析二级电离常数
H++HA-,从图中pH=4.2分析二级电离常数![]() ;故答案为:H2A
;故答案为:H2A![]() H++HA-;104.2。
H++HA-;104.2。
⑵已知25 ℃时HF的Ka=10-3.45,根据图中pH = 1.2信息得出![]() ,因此酸强弱顺序为H2A>HF>HA-,将少量H2A的溶液加入足量NaF溶液中,发生反应的离子方程式为H2A + F- = HF + HA-;故答案为:H2A + F- = HF + HA-。
,因此酸强弱顺序为H2A>HF>HA-,将少量H2A的溶液加入足量NaF溶液中,发生反应的离子方程式为H2A + F- = HF + HA-;故答案为:H2A + F- = HF + HA-。

 世纪百通主体课堂小学课时同步达标系列答案
世纪百通主体课堂小学课时同步达标系列答案 世纪百通优练测系列答案
世纪百通优练测系列答案【题目】根据下列实验操作和现象所得出的结论正确的是
选项 | 实验操作和现象 | 实验结论 |
A | 向20%蔗糖溶液中加入少量稀H2SO4,加热;再加入银氨溶液,水浴加热后未出现银镜 | 蔗糖未水解 |
B | 卤代烃Y与NaOH乙醇溶液共热后,加入足量稀硝酸,再滴加AgNO3溶液,产生白色沉淀 | 说明卤代烃Y中含有氯原子 |
C | 向浑浊的苯酚试液中加饱和Na2CO3溶液,试液变澄清且无气体产生 | 说明苯酚的酸性强于碳酸 |
D | 向鸡蛋清溶液中加入少量CuSO4溶液,出现浑浊 | 蛋白质发生了盐析 |
A. A B. B C. C D. D