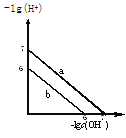
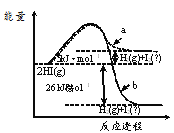
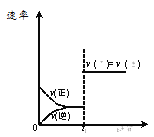
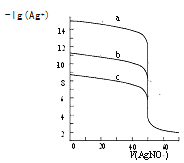
题目内容
【题目】元素a--f在周期表中的位置如表所示,下列有关说法正确的是
| ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA |
二 | c | d | |||||
三 | a | b | e | f |
A. c、d、e的氢化物中,e的氢化物沸点最高
B. a、b、d三种元素的离子半径:a >b >d
C. 六种元素中,a元素的金属性最强
D. e、f的氧化物对应的水化物的酸性依次增强
【答案】C
【解析】
由元素周期表位置可知,a是钠元素,b是铝元素,c是氮元素,d是氧元素,e是硫元素,f是氯元素。
A. 氮元素、氧元素、硫元素的氢化物中,因为水分子之间存在氢键,氧元素的氢化物沸点最高,故A错误;
B. 因为核外电子排布相同,核电荷数越大,离子半径越小。所以钠元素、铝元素、氧元素三种元素的离子半径:d > a > b,故B错误;
C. 同周期从左到右金属性减弱,同主族从上到下金属性增强。故六种元素中,钠元素的金属性最强,故C正确;
D. 硫元素、氯元素的最高价氧化物对应的水化物的酸性依次增强,故D错误;
答案选C。

 阅读快车系列答案
阅读快车系列答案【题目】下表是元素周期表的一部分,用化学用语回答下列问题:
族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
1 | ① | |||||||
2 | ② | ③ | ④ | |||||
3 | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | ⑩ | ||
4 |
(1)请画出元素⑨阴离子的结构示意图:________________________________。
(2)③⑤⑧的原子半径由小到大的顺序为________(填元素符号)。
(3)⑤和⑦的最高价氧化物对应水化物的碱性强弱为______>______(填化学式)。
(4)③⑤两种元素的原子按1∶1组成的常见化合物的电子式为__________。
(5)用电子式表示⑥和⑨形成的化合物的过程:______________________________。
【题目】下列“实验结论”与“实验操作及现象”相符的一组是( )
选项 | 实验操作及现象 | 实验结论 |
A | 向紫色石蕊溶液中加入氯水,溶液先变红,随后褪色 | 氯水中含有酸性物质和漂白性物质 |
B | 向某溶液中加入盐酸,产生能使澄清石灰水变浑浊的气体 | 该溶液中一定含有CO |
C | 向某溶液中加入AgNO3溶液,产生白色沉淀 | 该溶液中一定含有Cl- |
D | 向蔗糖中滴加浓硫酸,蔗糖变黑 | 浓硫酸有吸水性 |
A.AB.BC.CD.D