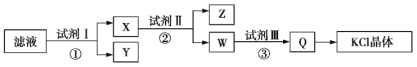
题目内容
【题目】反应4NH3(g)+5O2(g)![]() 4NO(g)+6H2O(g) ΔH=-akJ·mol-l(a>0),一定条件下在容积为5L的密闭容器中投入1molNH3和1molO2,2min末NO的物质的量增加了0.4mol,下列说法正确的是( )
4NO(g)+6H2O(g) ΔH=-akJ·mol-l(a>0),一定条件下在容积为5L的密闭容器中投入1molNH3和1molO2,2min末NO的物质的量增加了0.4mol,下列说法正确的是( )
A.2min末,c(H2O)=0.6mol·L-1
B.用氧气表示2min内的平均反应速率:v(O2)=0.25mol·L-1·min-1
C.2min时反应放出的热量等于0.1akJ
D.2min内,NH3的转化率小于O2的转化率
【答案】D
【解析】
A.初始投料为1molNH3和1molO2,容器体积为5L,根据题意列三段式有:

根据三段式可知2min末,c(H2O)=0.12mol·L-1,故A错误;
B.2min内氧气的浓度变化为0.1 mol·L-1,所以v(O2)=![]() =0.05 mol·L-1·min-1,故B错误;
=0.05 mol·L-1·min-1,故B错误;
C.根据热化学方程式可知当产生4molNO时放出的热量为akJ,2min内共生成0.4molNO,所以2min内放出的热量为0.1akJ,但不能说2min时这一时刻放出的热量为0.1akJ,故C错误;
D.氨气和氧气的初始投料相同,但单位时间内氧气的变化量更大,所以氧气的转化率更大,故D正确;
故答案为D。

 阅读快车系列答案
阅读快车系列答案【题目】元素周期表是学习化学的重要工具,它隐含许多信息和规律。下表所列是六种短周期元素的原子半径及主要化合价(已知铍元素的原子半径为0.089 nm)。
元素代号 | A | B | C | D | X | Y |
原子半径/nm | 0.037 | 0.143 | 0.102 | 0.099 | 0.074 | 0.075 |
主要化合价 | +1 | +3 | +6,-2 | -1 | -2 | +5,-3 |
(1)C元素在周期表中的位置为___, 其离子结构示意图为:____。
(2)B的最高价氧化物对应的水化物与Y的最高价氧化物对应的水化物反应的离子方程式为____。
(3)关于C、D 两种元素说法正确的是_________(填序号)
a.简单离子的半径D>C b.气态氢化物的稳定性D比C强 c.最高价氧化物对应的水化物的酸性C比D强
(4)写出由A、D、X三种元素组成的某种可以消毒杀菌物质的电子式_____________。
(5)比较Y元素与其同族短周期元素的氢化物的稳定性 _______(填氢化物化学式),
【题目】元素a--f在周期表中的位置如表所示,下列有关说法正确的是
| ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA |
二 | c | d | |||||
三 | a | b | e | f |
A. c、d、e的氢化物中,e的氢化物沸点最高
B. a、b、d三种元素的离子半径:a >b >d
C. 六种元素中,a元素的金属性最强
D. e、f的氧化物对应的水化物的酸性依次增强