题目内容
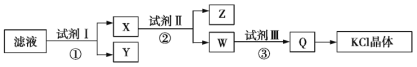
【题目】实验室制备苯甲醇和苯甲酸的化学原理是2C6H5CHO+KOH![]() C6H5CH2OH+C6H5COOK,C6H5COOK+HCl→C6H5COOH+KCl。已知苯甲醛易被空气氧化;苯甲醇的沸点为205.3 ℃,微溶于水,易溶于乙醚;苯甲酸的熔点为121.7 ℃,沸点为249 ℃,微溶于水,易溶于乙醚;乙醚的沸点为34.8 ℃,难溶于水。制备苯甲醇和苯甲酸的主要过程如下所示:
C6H5CH2OH+C6H5COOK,C6H5COOK+HCl→C6H5COOH+KCl。已知苯甲醛易被空气氧化;苯甲醇的沸点为205.3 ℃,微溶于水,易溶于乙醚;苯甲酸的熔点为121.7 ℃,沸点为249 ℃,微溶于水,易溶于乙醚;乙醚的沸点为34.8 ℃,难溶于水。制备苯甲醇和苯甲酸的主要过程如下所示:

根据以上信息判断,下列说法错误的是
A. 操作Ⅰ是萃取分液
B. 操作Ⅱ蒸馏得到的产品甲是苯甲醇
C. 操作Ⅲ过滤得到的产品乙是苯甲酸钾
D. 乙醚溶液中所溶解的主要成分是苯甲醇
【答案】C
【解析】
由流程可以知道,苯甲醛与KOH反应生成苯甲醇、苯甲酸钾,然后加水、乙醚萃取苯甲醇,则乙醚溶液中含苯甲醇,操作II为蒸馏,得到产品甲为苯甲醇;水溶液中含苯甲酸钾,加盐酸发生强酸制取弱酸的反应,生成苯甲酸,苯甲酸的溶解度小,则操作Ⅲ为过滤,则产品乙为苯甲酸,以此来解答。
A.操作Ⅰ加入水、乙醚后分层,分离乙醚溶液与水溶液为分液,则为萃取分液,所以A选项是正确的;
B.操作Ⅱ分离互溶的乙醚、苯甲醇,蒸馏所得产品甲是苯甲醇,所以B选项是正确的;
C.由上述分析,操作Ⅲ为过滤,则产品乙为苯甲酸,故C错误;
D.由上述分析可以知道,乙醚溶液中所溶解的主要成分是苯甲醇,所以D选项是正确的。
答案选C。

 阅读快车系列答案
阅读快车系列答案【题目】元素周期表是学习化学的重要工具,它隐含许多信息和规律。下表所列是六种短周期元素的原子半径及主要化合价(已知铍元素的原子半径为0.089 nm)。
元素代号 | A | B | C | D | X | Y |
原子半径/nm | 0.037 | 0.143 | 0.102 | 0.099 | 0.074 | 0.075 |
主要化合价 | +1 | +3 | +6,-2 | -1 | -2 | +5,-3 |
(1)C元素在周期表中的位置为___, 其离子结构示意图为:____。
(2)B的最高价氧化物对应的水化物与Y的最高价氧化物对应的水化物反应的离子方程式为____。
(3)关于C、D 两种元素说法正确的是_________(填序号)
a.简单离子的半径D>C b.气态氢化物的稳定性D比C强 c.最高价氧化物对应的水化物的酸性C比D强
(4)写出由A、D、X三种元素组成的某种可以消毒杀菌物质的电子式_____________。
(5)比较Y元素与其同族短周期元素的氢化物的稳定性 _______(填氢化物化学式),
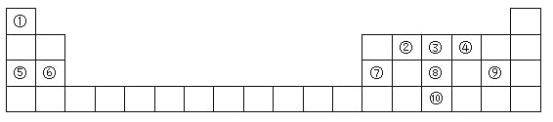
【题目】元素a--f在周期表中的位置如表所示,下列有关说法正确的是
| ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA |
二 | c | d | |||||
三 | a | b | e | f |
A. c、d、e的氢化物中,e的氢化物沸点最高
B. a、b、d三种元素的离子半径:a >b >d
C. 六种元素中,a元素的金属性最强
D. e、f的氧化物对应的水化物的酸性依次增强