题目内容
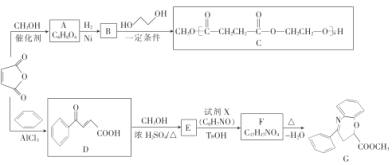
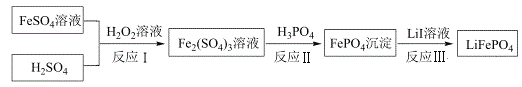
【题目】2019年诺贝尔化学奖颁给锂离子电池领域,获奖科学家的重要贡献之一是研发出了电极材料——磷酸亚铁锂(LiFePO4)。LiFePO4的一种制备方法如图。
已知:H3PO4能电离出PO![]() 。
。
(1)LiFePO4中,铁元素的化合价为_____。
(2)反应I中H2O2的作用是_____。
(3)检测反应II中铁离子是否完全反应的操作是_____。(离子检验常用的表达方式为:取xx试剂,向其中滴加xx,若出现xx现象,则说明xx结论。)
(4)反应Ⅲ的化学方程式是_____。
【答案】+2 氧化剂,将Fe2+氧化为Fe3+ 取少量反应Ⅱ中的滤液,向其中滴加KSCN溶液,若溶液不变红(或无现象),则说明反应Ⅱ中铁离子完全反应 2FePO4+2LiI=2LiFePO4+I2
【解析】
由工艺流程分析可知,FeSO4被H2O2在酸性条件下氧化生成Fe2(SO4)3,Fe2(SO4)3与H3PO4反应生成FePO4沉淀,FePO4与LiI溶液发生氧化还原反应2FePO4+2LiI=2LiFePO4+I2得到LiFePO4,据此分析解答问题。
(1)根据化合物元素化合价代数和为0可知,LiFePO4中Li为+1价,![]() 为-3价,则铁元素的化合价为+2价,故答案为:+2;
为-3价,则铁元素的化合价为+2价,故答案为:+2;
(2)根据分析,反应Ⅰ中H2O2在酸性条件下将Fe2+氧化为Fe3+,故答案为:作氧化剂,将Fe2+氧化为Fe3+;
(3)一般用KSCN溶液检验Fe3+,因此检测反应II中铁离子是否完全反应,可取少量反应Ⅱ中的滤液,向其中滴加KSCN溶液,若溶液不变红(或无现象),则说明反应Ⅱ中铁离子完全反应,故答案为:取少量反应Ⅱ中的滤液,向其中滴加KSCN溶液,若溶液不变红(或无现象),则说明反应Ⅱ中铁离子完全反应;
(4)反应Ⅲ为FePO4与LiI溶液发生氧化还原反应生成LiFePO4,反应的化学方程式为2FePO4+2LiI=2LiFePO4+I2,故答案为:2FePO4+2LiI=2LiFePO4+I2。

 开心快乐假期作业暑假作业西安出版社系列答案
开心快乐假期作业暑假作业西安出版社系列答案 名题训练系列答案
名题训练系列答案 期末集结号系列答案
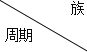
期末集结号系列答案【题目】元素a--f在周期表中的位置如表所示,下列有关说法正确的是
| ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA |
二 | c | d | |||||
三 | a | b | e | f |
A. c、d、e的氢化物中,e的氢化物沸点最高
B. a、b、d三种元素的离子半径:a >b >d
C. 六种元素中,a元素的金属性最强
D. e、f的氧化物对应的水化物的酸性依次增强