题目内容
【题目】食盐中所加的碘以碘酸钾(KIO3)形式存在。根据反应:IO![]() +I-+H+→I2+H2O(未配平),可用KI淀粉试纸和食醋进行实验,证明加碘食盐中存在IO
+I-+H+→I2+H2O(未配平),可用KI淀粉试纸和食醋进行实验,证明加碘食盐中存在IO![]() 。下列说法不正确的是( )
。下列说法不正确的是( )
A.上述反应中氧化剂和还原剂的物质的量之比为1∶5
B.实验时可观察到试纸变蓝
C.实验可证明该条件下I-的还原性强于Cl-
D.食醋中含有的乙酸是强酸,它能提供反应所需的H+
【答案】D
【解析】
配平后的反应为:IO![]() +5I-+6H+═3I2+3H2O,结合实验的原理和现象分析解答。
+5I-+6H+═3I2+3H2O,结合实验的原理和现象分析解答。
A.配平后的反应为:IO![]() +5I-+6H+═3I2+3H2O,反应中碘酸根离子中碘元素化合价由+5价变化为0价,IO
+5I-+6H+═3I2+3H2O,反应中碘酸根离子中碘元素化合价由+5价变化为0价,IO![]() 为氧化剂,碘离子中I的化合价由-1价变化为0价,I-为还原剂,则反应中氧化剂和还原剂的物质的量之比为1∶5,故A正确;
为氧化剂,碘离子中I的化合价由-1价变化为0价,I-为还原剂,则反应中氧化剂和还原剂的物质的量之比为1∶5,故A正确;
B.用淀粉KI试纸和食醋进行实验,发生反应IO![]() +5I-+6H+═3I2+3H2O,生成的碘单质遇到淀粉变蓝色,故B正确;
+5I-+6H+═3I2+3H2O,生成的碘单质遇到淀粉变蓝色,故B正确;
C.食盐中含有Cl-,在含有IO![]() 和Cl-的体系中加入KI淀粉试纸和食醋进行实验,碘离子被氧化,而Cl-不被氧化,所以实验可证明该条件下I-还原性强于Cl-,故C正确;
和Cl-的体系中加入KI淀粉试纸和食醋进行实验,碘离子被氧化,而Cl-不被氧化,所以实验可证明该条件下I-还原性强于Cl-,故C正确;
D.乙酸为弱酸,不是强酸,故D错误;
故选D。

【题目】元素a--f在周期表中的位置如表所示,下列有关说法正确的是
| ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA |
二 | c | d | |||||
三 | a | b | e | f |
A. c、d、e的氢化物中,e的氢化物沸点最高
B. a、b、d三种元素的离子半径:a >b >d
C. 六种元素中,a元素的金属性最强
D. e、f的氧化物对应的水化物的酸性依次增强
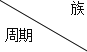
【题目】X、Y、Z、W均为短周期元素,它们在元素周期表中的位置如图所示。下列说法正确的是( )
X | Y | |
Z | W |
A.原子半径:X>Y>Z>W
B.若它们都能形成气态氢化物,则Z的氢化物稳定性最强
C.若常温下它们的单质中只有Z为固态,则W单质的水溶液具有漂白性
D.若X与W形成的化合物的电子式是![]() ,则Y属于第ⅣA族
,则Y属于第ⅣA族
【题目】下面是丁醇的两种同分异构体,其结构简式、沸点及熔点如下表所示:
异丁醇 | 叔丁醇 | |
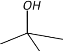
结构简式 |
|
|
沸点/℃ | 108 | 82.3 |
熔点/℃ | -108 | 25.5 |
下列说法不正确的是
A. 用系统命名法给异丁醇命名为:2-甲基-1-丙醇
B. 异丁醇的核磁共振氢谱有三组峰,且面积之比是1∶2∶6
C. 用降温结晶的方法可将叔丁醇从二者的混合物中结晶出来
D. 两种醇发生消去反应后得到同一种烯烃