题目内容
【题目】下表是元素周期表的一部分,用化学用语回答下列问题:
族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
1 | ① | |||||||
2 | ② | ③ | ④ | |||||
3 | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | ⑩ | ||
4 |
(1)请画出元素⑨阴离子的结构示意图:________________________________。
(2)③⑤⑧的原子半径由小到大的顺序为________(填元素符号)。
(3)⑤和⑦的最高价氧化物对应水化物的碱性强弱为______>______(填化学式)。
(4)③⑤两种元素的原子按1∶1组成的常见化合物的电子式为__________。
(5)用电子式表示⑥和⑨形成的化合物的过程:______________________________。
【答案】![]() O<S<Na NaOH Al(OH)3
O<S<Na NaOH Al(OH)3 ![]()
![]()
【解析】
根据元素在周期表中的位置首先判断出元素,然后结合元素周期律和物质的性质分析解答。
根据元素在周期表中的位置可知①~⑩分别是H、N、O、F、Na、Mg、Al、S、Cl、Ar。则
(1)元素⑨是Cl,其阴离子的结构示意图为![]() 。
。
(2)同周期自左向右原子半径逐渐减小,同主族从上到下原子半径逐渐增大,则③⑤⑧的原子半径由小到大的顺序为O<S<Na。
(3)同周期自左向右金属性逐渐减小,最高价氧化物水化物的碱性逐渐减弱,则⑤和⑦的最高价氧化物对应水化物的碱性强弱为NaOH>Al(OH)3。
(4)③⑤两种元素的原子按1∶1组成的常见化合物是过氧化钠,电子式为![]() 。
。
(5)⑥和⑨形成的化合物是离子化合物氯化镁,则用电子式表示⑥和⑨形成的化合物的过程为![]() 。
。

 名校课堂系列答案
名校课堂系列答案【题目】砷化镓是继硅之后研究最深入、应用最广泛的半导体材料。回答下列问题:
(1)Ga基态原子核外电子排布式为__________________,As基态原子核外有____个未成对电子。
(2)Ga、As、Se的第一电离能由大到小的顺序是___________,Ga、As、Se的电负性由大到小的顺序是_________________。
(3)比较下列镓的卤化物的熔点和佛点,分析其变化规律及原因:_________________。
镓的卤化物 | GaI3 | GaBr3 | GaCl3 |
熔点/℃ | 77.75 | 122.3 | 211.5 |
沸点/℃ | 201.2 | 279 | 346 |
GaF3的熔点超过1000℃,可能的原因是______________。
(4)二水合草酸镓的结构如图1所示,其中镓原子的配位数为___________,草酸根中碳原子的杂化轨道类型为______________。
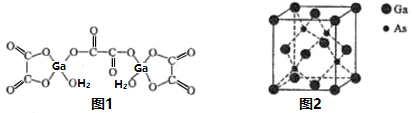
(5)砷化镓的立方晶胞结构如图2所示,晶胞参数为a=0.565nm,砷化镓晶体的密度为_____g/cm3(设NA为阿伏加德罗常数的值,列出计算式即可)。