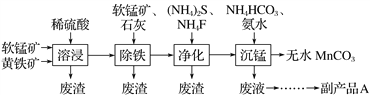
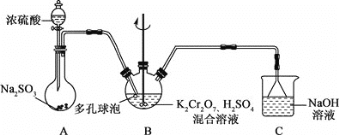
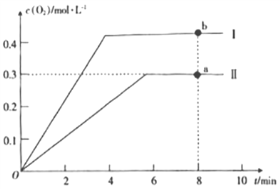
题目内容
【题目】下列对化学用语的理解中正确的是( )
A.原子结构示意图:![]() 可以表示35Cl,也可以表示37Cl
可以表示35Cl,也可以表示37Cl
B.电子式:![]() 可以表示羟基,也可以表示氢氧根离子
可以表示羟基,也可以表示氢氧根离子
C.比例模型![]() :可以表示甲烷分子,也可以表示四氯化碳分子
:可以表示甲烷分子,也可以表示四氯化碳分子
D.结构简式(CH3)2CHOH:可以表示1-丙醇,也可以表示2-丙醇
【答案】A
【解析】
A.35Cl和37Cl是同种元素,质子数相同,电子数也相同,所以原子结构示意图也相同,故A正确;
B.羟基的电子式为![]() ,氢氧根离子的电子式为
,氢氧根离子的电子式为![]() ,故B错误;
,故B错误;
C.比例模型中应符合原子的大小,氯原子半径大于碳原子半径,所以不能用同一个比例模型表示甲烷和四氯化碳,故C错误;
D.(CH3)2CHOH中主碳链有3个碳,羟基在二号碳上,仅可以表示2-丙醇,故D错误;
综上所述,答案为A。

【题目】现有部分短周期元素的性质或原子结构如下表:
元素编号 | 元素性质或原子结构 |
T | M层上有6个电子 |
X | 最外层电子数是次外层电子数的2倍 |
Y | 常温下单质为双原子分子,其氢化物水溶液呈碱性 |
Z | 元素最高正价是+7价 |
W | 其单质既能跟酸反应,又能跟碱反应,都产生H2 |
(1)元素X的一种同位素可测定文物年代,这种同位素的符号是___。
(2)元素Y与氢元素形成一种离子YH![]() ,写出该微粒的化学式:___(用元素符号表示).
,写出该微粒的化学式:___(用元素符号表示).
(3)元素Z与元素T相比,非金属性较强的是___(用元素符号表示),下列表述中能证明这一事实的是___。
①常温下Z的单质和T的单质状态不同
②Z的氢化物比T的氢化物稳定
③一定条件下Z和T的单质都能与氢氧化钠溶液反应
(4)探寻物质的性质差异性是学习的重要方法之一。T、X、Y、Z四种元素的最高价氧化物对应的水化物中化学性质明显不同于其他三种的是___(填化学式),理由是_____ ;Z的最高价氧化物对应的水化物与W的最高价氧化物对应的水化物反应的离子方程式为___。