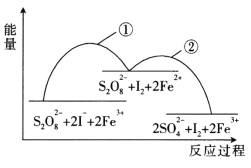
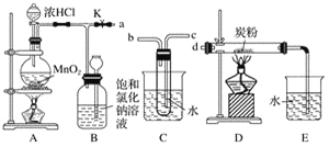
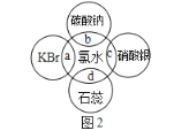
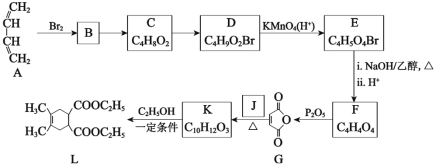
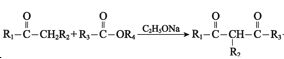
题目内容
【题目】一定条件下,将amolA与15molB的混合气体通入一固定体积为5L的密闭容器中,发生如下反应:A(g)+3B(g)![]() 2C(g)
2C(g)
(1)若反应进行到10min时达到平衡,n1(A)=13mol,n1(C)=6mol,;计算a的值___;这段时间内的C平均反应速率为___。
(2)反应达平衡时,B的转化率为分别为___;A的体积分数为___。
(3)下列操作能使该反应的反应速率增大的是___。
A.向密闭容器中通入氦气增大压强
B.增大A的浓度
C.适当升高温度
D.将容器的体积扩大至10L
(4)反应过程中容器内气体的密度是___(填“增大”、“减小”或“不变”,下同),平均相对分子质量是___。
【答案】16mol 0.12molL-1min-1 60% 52% BC 不变 增大
【解析】
从已知条件列出反应的三段式: 。
。
(1)根据反应方程式,生成6molC,则消耗![]() ,反应初始
,反应初始![]() ;这段时间内的C平均反应速率为
;这段时间内的C平均反应速率为![]() ;故答案为:16mol;0.12molL-1min-1;
;故答案为:16mol;0.12molL-1min-1;
(2)反应达平衡时的三段式:

B的转化率为:![]() ;A的体积分数为:
;A的体积分数为:![]() ;故答案为:60%;52%;
;故答案为:60%;52%;
(3) A.该反应为恒容密闭容器,通入氦气,但反应物的浓度不变,化学反应速率不变,A错误;
B.A是气体,增大A的浓度,即增大反应物的浓度,能加快化学反应速率,B正确;
C.适当升高温度,化学反应速率加快,C正确;
D.将容器的体积扩大至10L,反应物的浓度减小,化学反应速率减慢,D错误;
答案选BC。
(4)该反应在恒容密闭容器内进行,体积不变,体系内的物质全是气体,故总质量不变,则反应过程中容器内气体的密度是不变的;该反应气体物质的量减小,而质量不变,故平均相对分子质量是增大的;答案为:不变;增大。

 阅读快车系列答案
阅读快车系列答案【题目】下表是元素周期表的一部分,针对表中的①~⑩种元素,请用化学用语回答下列问题:
族 周期 | IA | IIA | IIIA | IVA | VA | VIA | VIIA | 0 |
2 | ⑥ | ⑦ | ⑧ | |||||
3 | ① | ③ | ⑤ | ⑨ | ⑩ | |||
4 | ② | ④ |
(1) 在③~⑦元素中,原子半径最大的是__________(填元素符号);
(2) ⑦元素的最高价氧化物对应的水化物与其氢化物能生成盐M,M中含有的化学键类型有________________________;
(3)写出元素①和⑧的单质在加热条件下反应生成的化合物的电子式:_____________。
(4) ③、⑤、⑦、⑧形成的离子,其半径由小到大的顺序是________(填离子符号)
(5) ①~⑨中元素最高价氧化物对应的水化物中酸性最强的是_____________(填物质化学式),呈两性的氢氧化物是_________(填物质化学式);该化合物与NaOH溶液反应的离子方程式为___________。
(6) 用电子式表示元素③与⑨形成化合物的过程_____________________________。
(7)写出工业冶炼⑤的化学方程式:_______________________________________。