题目内容
【题目】CO、CO2是化石燃料燃烧的主要产物。
(1)将含0.02mol CO2和0.01 mol CO的混合气体通入有足量Na2O2固体的密闭容器中,同时不断地用电火花点燃,充分反应后,固体质量增加_____g。
(2)已知:2CO(g)+O2(g)==2CO2(g) △H=-566.0kJ/mol,键能Eo-o=499.0kJ/mol。则反应:CO(g)+O2(g)![]() CO2(g)+O(g)的△H=_________kJ/mol。
CO2(g)+O(g)的△H=_________kJ/mol。
(3)在某密闭容器中发生反应:2CO2(g)![]() 2CO(g)+O2(g),1molCO2在不同温度下的平衡分解量如图所示。
2CO(g)+O2(g),1molCO2在不同温度下的平衡分解量如图所示。

①恒温恒容条件下,能表示该可逆反应达到平衡状态的有___(填字母)。
A.CO的体积分数保持不变 B.容器内混合气体的密度保持不变
C.容器内混合气体的平均摩尔质量保持不变
D.单位时间内,消耗CO的浓度等于生成CO2的浓度
②分析上图,若1500℃时反应达到平衡状态,且容器体积为1L,则此时反应的平衡常数K=___(计算结果保留1位小数)。
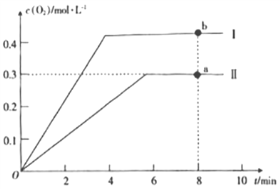
③向2L的恒容密闭容器中充入2molCO2(g),发生反应: 2CO2(g)![]() 2CO(g)+O2(g),测得温度为T℃时,容器内O2的物质的量浓度随时间的变化如曲线II所示。图中曲线I表示相对于曲线II仅改变一种反应条件后,c(O2)随时间的变化,则改变的条件是____;a、b两点用CO浓度变化表示的净反应速率关系为va(CO)____(填“>”“<”或“=”)vb(CO)。
2CO(g)+O2(g),测得温度为T℃时,容器内O2的物质的量浓度随时间的变化如曲线II所示。图中曲线I表示相对于曲线II仅改变一种反应条件后,c(O2)随时间的变化,则改变的条件是____;a、b两点用CO浓度变化表示的净反应速率关系为va(CO)____(填“>”“<”或“=”)vb(CO)。
【答案】 0.84g -33.5 AC 3.2×10-8mol/L 升温 <
【解析】(1)①Na2O2与CO2反应:2CO2+2Na2O2=2Na2CO3+O2,电火花不断引燃,发生反应:2CO+O2![]() 2CO2,整个过程相当于CO+Na2O2=Na2CO3,由于加入足量的Na2O2固体,则反应后的气体只能为O2,所以反应后生成物的化学式是Na2CO3、O2,将含0.02 molCO2和0.01molCO的混合气体通入有足量Na2O2固体的密闭容器中,固体质量增加为CO的质量=(0.02mol+0.01mol)×28g/mol=0.84g,故答案为:0.84;
2CO2,整个过程相当于CO+Na2O2=Na2CO3,由于加入足量的Na2O2固体,则反应后的气体只能为O2,所以反应后生成物的化学式是Na2CO3、O2,将含0.02 molCO2和0.01molCO的混合气体通入有足量Na2O2固体的密闭容器中,固体质量增加为CO的质量=(0.02mol+0.01mol)×28g/mol=0.84g,故答案为:0.84;
(2)①已知:2CO(g)+O2(g)=2CO2 (g)△H=-566.0kJmol-1;键能Eo-o=499.0kJ/mol,即O2(g)=2O(g)△H=499kJmol-1;由盖斯定律:两个方程相加除以2即可得到CO(g)+O2(g)CO2 (g)+O(g)△H=-33.5kJmol-1;故答案为:-33.5;
(3)①A.CO的体积分数保持不变是平衡标志,故A正确;B.反应前后气体质量不变,体积不变,容器内混合气体的密度始终保持不变,不能说明反应达到平衡状态,故B错误;C.反应前后气体物质的量变化,气体质量不变,容器内混合气体的平均摩尔质量保持不变说明反应达到平衡状态,故C正确;D.2CO2(g)2CO(g)+O2(g),单位时间内,消耗CO的浓度等于生成CO2 的浓度说明速率相同反应逆向进行,不能说明反应达到平衡状态,故D错误;故答案为:AC;
②设生成的氧气为xmol,
2CO2 (g)2CO(g)+O2(g)
起始量(mol):1 0 0
转化量(mol):2x 2x x
平衡量(mol):1-2x 2x x,
平衡时,氧气的体积分数为0.2,则![]() =0.2%,则x=0.002,则c(CO2)=0.996mol/L,c(CO)=0.004mol/L,c(O2)=0.002mol/L,则K=
=0.2%,则x=0.002,则c(CO2)=0.996mol/L,c(CO)=0.004mol/L,c(O2)=0.002mol/L,则K=![]() ≈3.2×10-8 molL-1,故答案为:3.2×10-8 molL-1;
≈3.2×10-8 molL-1,故答案为:3.2×10-8 molL-1;
③向2 L的恒容密闭容器中充入2molCO2(g),发生反应:2CO2(g)2CO(g)+O2(g),反应为吸热反应,图中曲线I表示相对于曲线II仅改变一种反应条件后c(O2)随时间的变化,曲线Ⅰ达到平衡时间缩短,平衡状态下氧气浓度增大,则改变的条件是升温,温度越高反应速率越大,则a、b两点用CO浓度变化表示的净反应速率关系为va(CO)<vb( CO),
故答案为:升温;<。