��Ŀ����
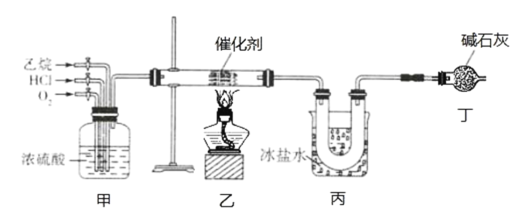
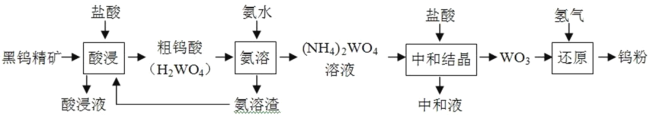
����Ŀ�������ٹ㷺����ұ�𡢻�е�����������ӵ������Ժ��پ���Ϊԭ��ұ���ٵ�������ͼ��ʾ��
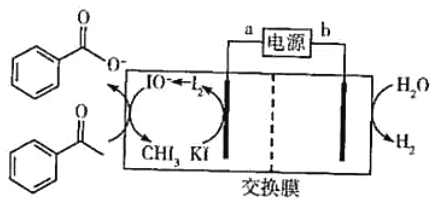
��ش��������⡣
��1�������Һ���к��� Fe3����Fe2���Ƚ������ӣ��������е� Fe2����ʹ�����軯����Һ����Ӧ�����ӷ���ʽ Ϊ_____��
��2����������ʱ����ȣ���Ӧ�����¶Ȳ����� 70����ԭ��Ϊ_____��
��3�����кͽᾧ��ʱ(NH4)2WO4 �����ᷴӦ���� WO3 �Ļ�ѧ����ʽΪ_____���������к� Һ������Ҫ���ʵĵ���ʽΪ_____��
��4������ͼ����ƽ�������������������������̵�Ŀ��Ϊ__________��
��5�����ѺϽ��ڹ�ҵ��Ӧ�ù㷺�� NH4Fe(SO4)2 �ζ����ɲⶨ�Ͻ����ѵĺ�������ȡ w g ���ѺϽ��� HNO3-HF���Һ�ܽ⣬�� NaOH ��Һ������������Ԫ�غ�������ܽ⣬�ý������� Ti4����ԭΪ Ti3��������Һ�мӼ��� KSCN ��ָʾ������ c mol/L �� NH4Fe(SO4)2 ����Һ�ζ�����Һ�Ժ�ɫ�����ı���Һ�����Ϊ V mL��
�ٵζ�ʱ������Ӧ�����ӷ���ʽ��_____��
����Ʒ���ѵĺ���Ϊ_____%���ú� w��c��V ��ʽ�ӱ�ʾ����
���𰸡�2[Fe(CN)6]3 + 3Fe2�� = Fe3[Fe(CN)6]2�� �¶ȹ�����ɰ��������ӷ�����ɰ�ˮ�������� (NH4)2WO4 + 2HCl = 2NH4Cl + WO3��+ H2O 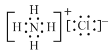 ��������ѭ�����ã���ߺ��پ���������� Ti3+ + Fe3+ =Ti4+ + Fe2+
��������ѭ�����ã���ߺ��پ���������� Ti3+ + Fe3+ =Ti4+ + Fe2+ ![]()
��������
���پ��������ᷴӦ���ɴ����ᣬ���백ˮ���а��ܣ������ܵİ������ٴ��������ߺ��پ���������ʣ����ܺ�õ�����泥���������õ��кͽᾧ�����٣���������ԭ�õ��ٷۡ�
�������Һ���к���Fe3����Fe2���Ƚ������ӣ��������е�Fe2����ʹ�����軯����Һ����Ӧ�������軯������������Ӧ�����ӷ���ʽΪ2[Fe(CN)6]3 + 3Fe2�� = Fe3[Fe(CN)6]2�����ʴ�Ϊ��2[Fe(CN)6]3 + 3Fe2�� = Fe3[Fe(CN)6]2����
�����¿��Լӿ췴Ӧ���ʣ��������ӷ�����˼����¶Ȳ��ܹ��ߣ���������ʱ����ȣ���Ӧ�����¶Ȳ�����70����ԭ��Ϊ�¶ȹ�����ɰ��������ӷ�����ɰ�ˮ�������ʴ�Ϊ���¶ȹ�����ɰ��������ӷ�����ɰ�ˮ��������
�����кͽᾧ��ʱ(NH4)2WO4 �����ᷴӦ����WO3�Ļ�ѧ����ʽΪ(NH4)2WO4 + 2HCl = 2NH4Cl + WO3��+ H2O���������к�Һ������Ҫ������NH4Cl�������ʽΪ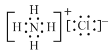 ���ʴ�Ϊ��(NH4)2WO4 + 2HCl = 2NH4Cl + WO3��+ H2O��
���ʴ�Ϊ��(NH4)2WO4 + 2HCl = 2NH4Cl + WO3��+ H2O��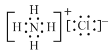 ��
��
�ȴ�����ͼ�п��Կ�����������������������������̵�Ŀ��Ϊ��������ѭ�����ã���ߺ��پ���������ʣ��ʴ�Ϊ����������ѭ�����ã���ߺ��پ���������ʡ�
�����ζ�ʱTi3+��Fe3+��Ӧ����Ti4+��Fe2+���䷢����Ӧ�����ӷ���ʽ��Ti3+ + Fe3+ =Ti4+ + Fe2+���ʴ�Ϊ��Ti3+ + Fe3+ =Ti4+ + Fe2+��
����������ͷ���ʽ�õ���Ʒ���ѵ����ʵ���n(Ti3+)= c molL1��V��103L = cV ��103 mol����Ʒ���ѵĺ���Ϊ![]() ���ʴ�Ϊ��
���ʴ�Ϊ��![]() ��
��

����Ŀ��2018�꣬�����˳��ˡ�����Э����ʵ���ٹ�ҵ��ս�ԣ����й�ȴ�Ӵ��˻������ȣ�����ڹ�����ҹ������εĴ���������ҹ�������ǿ��������CO2���⻯�ϳɼ״������Ĺ�ҵ�������о���ʵ�ֿɳ�����չ��
(1)��֪��I.CO2(g)+H2(g)![]() H2O(g)+CO(g) ��H1=+41.1kJ/mol
H2O(g)+CO(g) ��H1=+41.1kJ/mol
II.CO(g)+2H2(g)![]() CH3OH(g) ��H2=��90.0kJ/mol
CH3OH(g) ��H2=��90.0kJ/mol
д��CO2���⻯�ϳɼ״����Ȼ�ѧ����ʽ:________��
(2)Ϊ���CH3OH�IJ��ʣ�������Ӧ���õ�������________(��ѡ����ĸ����
a.���¸�ѹ b.���µ�ѹ c.���µ�ѹ d.���¸�ѹ
(3)250��ʱ���ں����ܱ���������CO2(g)���⻯�ϳ� CH3OH(g)����ͬͶ�ϱ�[n(H2)/n(CO2)]ʱij��Ӧ��X��ƽ��ת���ʱ仯������ͼ��ʾ����Ӧ��X��_______(����CO2������H2�������ж�������_______��
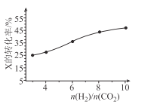
(4)250��ʱ�������Ϊ2.0 L�ĺ����ܱ������м���6mol H2��2mol CO2�ʹ������� CO2���⻯�ϳɼ״��ķ�Ӧ��10 minʱ��Ӧ�ﵽƽ�⣬���c(CH3OH) = 0.75 mol L-1��
��ǰ10 min�ڵ�ƽ����Ӧ����H2=_______ mol L-1 min-1��
�����¶��£��÷�Ӧ�Ļ�ѧƽ�ⳣ��K =_______��
�������ͷ�Ӧ�����뷴Ӧ��ת���ʺͲ����ѡ���Ը߶���ء�������ͬͶ�ϱȺ���ͬ��Ӧʱ�䣬����ʵ���������±���ʾ��
ʵ���� | �¶�(K) | ���� | CO2ת����(%) | �״�ѡ����(%) |
A | 543 | Cu/ZnO���װ� | 12.3 | 42.3 |
B | 543 | Cu/ZnO����Ƭ | 11.9 | 72.7 |
C | 553 | Cu/ZnO���װ� | 15.3 | 39.1 |
D | 553 | Cu/ZnO����Ƭ | 12.0 | 70.6 |
�����ϱ��������ݣ���CO2�����״�������ѡ��Ϊ________������ĸ����
����Ŀ����һ���¶���,������X������Y ��0.16mol ���� 10L �����ܱ�������,�������������У�������ӦX(g)+Y(g) ![]() 2Z(g) ��H��0��һ��ʱ���ﵽƽ�⣬��Ӧ�����вⶨ���������������˵����ȷ����
2Z(g) ��H��0��һ��ʱ���ﵽƽ�⣬��Ӧ�����вⶨ���������������˵����ȷ����
t/min | 2 | 4 | 7 | 9 |
n(Y)mol | 0.12 | 0.11. | 0.10 | 0.10 |
A.��Ӧǰ 2min ��ƽ������ v��Z��=2.0��10-3mol��L-1min-1
B.�����������䣬��ƽ����ϵ���ٳ���0.16mol ���� X����ԭƽ����ȣ��ﵽ��ƽ��ʱ������ Y ��ת��������X �������������Z �������������
C.�����������䣬�����¶ȣ���Ӧ�ﵽ��ƽ��ǰ v (��)��v(��)
D.���������������䣬��ʼʱ����Һ�г���0.32mol����X ��0.32mol ���� Y������ƽ��ʱ��n(Z)��0.24mol