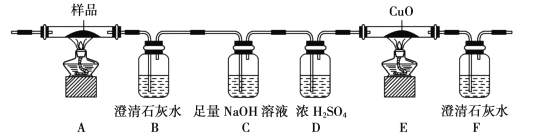
题目内容
【题目】2019年诺贝尔化学奖授予三位开发锂离子电池的科学家。某高能锂离子电池的反应方程式为Li1-xCoO2+LixC6![]() LiCoO2+C6(x<l)。以该锂离子电池为电源、苯乙酮为原料制备苯甲酸,工作原理如图所示(注明:酸化电解后的苯甲酸盐可以析出苯甲酸)。
LiCoO2+C6(x<l)。以该锂离子电池为电源、苯乙酮为原料制备苯甲酸,工作原理如图所示(注明:酸化电解后的苯甲酸盐可以析出苯甲酸)。
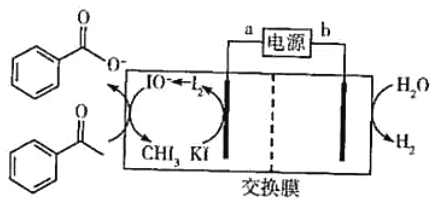
下列说法正确的是( )
A.锂离子电池的a极为负极
B.放电时,正极反应式为xLi++xe-+Li1-xCoO2=LiCoO2
C.交换膜为质子交换膜
D.每产生4.48LH2(标准状况),生成0.4molIO-
【答案】B
【解析】
与a相连的电极,KI变为I2,化合价升高,失电子被氧化,为电解池的阳极,所以a是正极,b为负极;制备苯甲酸原理为:电解池阴极发生反应:2H2O+2e-=H2↑+2OH-,OH-通过交换膜进入阳极,和阳极产生的I2发生如下反应:I2+2OH-=I-+IO-+H2O,I-离子继续在阳极反应,IO-将苯乙酮氧化成苯甲酸根离子,酸化后得到苯甲酸。
A.由分析可知,a极为正极,A错误;
B.由Li1-xCoO2+LixC6![]() LiCoO2+C6可知,放电时,Li1-xCoO2变为LiCoO2,Co化合价降低,得电子,被还原,Li1-xCoO2为正极材料,所以正极反应为:xLi++Li1-xCoO2+xe-= LiCoO2,B正确;
LiCoO2+C6可知,放电时,Li1-xCoO2变为LiCoO2,Co化合价降低,得电子,被还原,Li1-xCoO2为正极材料,所以正极反应为:xLi++Li1-xCoO2+xe-= LiCoO2,B正确;
C.由分析可知OH-通过交换膜到达左池反应,故应为阴离子交换膜,C错误;
D.根据电子守恒有:H2~2e-~I2~IO-,4.48L氢气的物质的量=![]() =0.2mol,生成IO-的物质的量=0.2mol,D错误。
=0.2mol,生成IO-的物质的量=0.2mol,D错误。
答案选B。

【题目】下列实验操作、现象和结论均正确,且存在对应关系的是
选项 | 实验操作 | 实验现象 | 结论 |
A | 将NaOH溶液逐滴滴加到AlC13溶液中至过量 | 先产生白色胶状沉淀,后沉淀溶解 | Al(OH)3是两性氢氧化物 |
B | NaHCO3溶液与NaAlO溶液混合 | 生成白色沉淀 | 结合H+的能力:CO32->AlO2- |
C | 向盛有Na2SiO3,溶液的试管中滴加1滴酚酞,然后逐滴加入稀盐酸至过量 | 试管中红色逐渐褪去,出现白色凝胶 | 非金属性:Cl>Si |
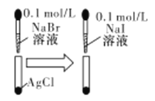
D |
| 白色固体先变为淡黄色,后变为黄色 | 溶度积常数:Ksp(AgCl)>Ksp(AgBr)>Ksp(AgI) |
A.AB.BC.CD.D