题目内容
12.(1)在100g浓度为c mol•L-1,密度为ρ g•cm-3的硫酸中加入一定量的水稀释成$\frac{c}{2}$mol•L-1,则加入水的体积小于100mL(填“=”、“>”或“<”,下同);(2)若把(1)中的H2SO4改成氨水,应加入水的体积大于100mL;
(3)若把(1)(2)中的物质的量的浓度均改为溶质的质量分数,则加入水的体积等于100mL.
分析 (1)稀释前后溶质的物质的量不变,则稀释后的体积为原硫酸溶液体积的2倍,稀释后硫酸溶液的密度减小,则稀释后溶液的质量小于200g,故加入水的质量小于100g;
(2)若把H2SO4改成氨水,稀释后氨水的密度增大,则稀释后溶液的质量大于200g,故加入水的质量大于100g;
(3)若把(1)(2)中的物质的量的浓度均改为溶质的质量分数,则则稀释后溶液的质量等于200g,故加入水的质量等于100g,
再根据V=$\frac{m}{ρ}$计算判断水的体积.
解答 解:(1)浓度由浓度为c mol•L-1稀释成$\frac{c}{2}$mol•L-1,稀释前后溶质的物质的量不变,则稀释后的体积为原硫酸溶液体积的2倍,稀释后硫酸溶液的密度减小,则稀释后溶液的质量小于200g,故加入水的质量小于100g,则加入水的体积小于$\frac{100g}{1g/mL}$=100mL,故答案为:小于;
(2)若把H2SO4改成氨水,稀释后氨水的密度增大,则稀释后溶液的质量大于200g,故加入水的质量大于100g,则加入水的体积大于$\frac{100g}{1g/mL}$=100mL,故答案为:大于;
(3)若把(1)(2)中的物质的量的浓度均改为溶质的质量分数,则则稀释后溶液的质量等于200g,故加入水的质量等于100g,则加入水的体积=$\frac{100g}{1g/mL}$=100mL,故答案为:等于.
点评 本题考查物质的量浓度、质量分数有关计算,注意对公式的理解与灵活应用,关键是明确硫酸溶液、氨水密度与浓度关系.

练习册系列答案
相关题目
2.下列有关氧化还原反应的叙述正确的是( )
| A. | 粮食酿酒经历淀粉→葡萄糖→乙醇,每一步均发生氧化还原反应 | |
| B. | 具有氧化性的物质在氧化还原反应中一定作氧化剂 | |
| C. | 在某些反应中可能所有元素的化合价都发生变化 | |
| D. | 单质甲能从盐溶液中置换出单质乙,单质甲一定发生氧化反应 |
20.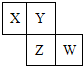 X、Y、Z、W均为短周期元素,它们在周期表中位置如图所示,若Y原子的最外层电子数是内层电子数的3倍,下列说法中正确的是( )
X、Y、Z、W均为短周期元素,它们在周期表中位置如图所示,若Y原子的最外层电子数是内层电子数的3倍,下列说法中正确的是( )
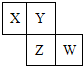 X、Y、Z、W均为短周期元素,它们在周期表中位置如图所示,若Y原子的最外层电子数是内层电子数的3倍,下列说法中正确的是( )
X、Y、Z、W均为短周期元素,它们在周期表中位置如图所示,若Y原子的最外层电子数是内层电子数的3倍,下列说法中正确的是( )| A. | 非金属性:W>Z>Y | |
| B. | 最高价氧化物对应水化物的酸性:Z>W>X | |
| C. | 气态氢化物的稳定性:X>Y>Z | |
| D. | 最高正化合价:W>Z>X |
11.25℃时,水中存在电离平衡:H2O?H++OH-,下列关于水的说法正确的是( )
| A. | 水的电离是吸热过程,升高温度不利于电离 | |
| B. | 向水中加入少量稀硫酸,水的离子积KW不变 | |
| C. | 含H+的溶液显酸性,含OH-的溶液显碱性 | |
| D. | 向水中加入少量氢氧化钠溶液,水的电离程度变大 |
12.下列有关化学用语表示正确的是( )
| A. | 乙炔的结构简式:C2H2 | |
| B. | S2-的结构示意图: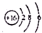 | |
| C. | 甲烷分子的球棍模型 | |
| D. | 硫酸钠的电离方程式:Na2S04=2Na++S042- |