题目内容
2.下列有关氧化还原反应的叙述正确的是( )| A. | 粮食酿酒经历淀粉→葡萄糖→乙醇,每一步均发生氧化还原反应 | |
| B. | 具有氧化性的物质在氧化还原反应中一定作氧化剂 | |
| C. | 在某些反应中可能所有元素的化合价都发生变化 | |
| D. | 单质甲能从盐溶液中置换出单质乙,单质甲一定发生氧化反应 |
分析 A.淀粉→葡萄糖为水解反应;
B.具有氧化性的物质在氧化还原反应可能为还原剂;
C.氧化还原反应中一定有元素的化合价变化,两种单质发生的化合反应中元素的化合价均变化;
D.单质甲能从盐溶液中置换出单质乙,甲可能失去电子,也可能得到电子.
解答 解:A.淀粉→葡萄糖为水解反应,不存在元素的化合价变化,不发生氧化还原反应,故A错误;
B.具有氧化性的物质在氧化还原反应可能为还原剂,如二氧化硫具有氧化性,与氯气反应时二氧化硫作还原剂,故B错误;
C.氧化还原反应中一定有元素的化合价变化,两种单质发生的化合反应中元素的化合价均变化,如氢气与氧气反应,故C正确;
D.单质甲能从盐溶液中置换出单质乙,甲可能失去电子,也可能得到电子,如Fe与硫酸铜的反应中Fe发生氧化还原、氯气与KI的反应中氯气发生还原反应,故D错误;
故选C.
点评 本题考查氧化还原反应,为高频考点,把握氧化还原反应中元素的化合价变化、常见的反应及特列等为解答的关键,侧重分析与应用能力的考查,题目难度不大.

练习册系列答案
相关题目
12.甲烷与氧气的反应式放热反应,下列对应的图象正确的是( )
| A. |  | B. |  | C. |  | D. |  |
10.130mol浓度为3mol•L-1是盐酸跟过量的锌片反应,为加快反应速率,又不影响生成氢气的总量,可采用的方法是( )
| A. | 加入适量的6mol•L-1的盐酸 | B. | 加入数滴氯化铜溶液 | ||
| C. | 加入数滴硝酸铜溶液 | D. | 加入适量的氯化钠溶液 |
7.金属钠久置空气中发生变质,欲证明所得固体中既含有NaOH又含有Na2CO3,可以选择的操作步骤有:
①固体溶解
②过滤
③加入过量BaCl2溶液
④加入过量CuCl2溶液
⑤加入足量盐酸
⑥滴加无色酚酞试液.你认为最可行的方案是( )
①固体溶解
②过滤
③加入过量BaCl2溶液
④加入过量CuCl2溶液
⑤加入足量盐酸
⑥滴加无色酚酞试液.你认为最可行的方案是( )
| A. | ①③②⑤ | B. | ①④②⑤ | C. | ①③②⑥ | D. | ①⑥⑤ |
14.X、Y、Z三种元素价电子排布分别为ns1、3s23p4、2s22p4,有关这三种元素的说法不正确的是( )
| A. | Y元素可显+6价 | |
| B. | X、Y、Z三种元素组成的化合物化学式可能是X2YZ3、X2YZ4等 | |
| C. | X、Y、Z三种元素组成的化合物不一定呈中性 | |
| D. | Y的电负性比Z大 |
11.全部由第三周期元素形成的化合物是( )
| A. | HF | B. | NO | C. | Na2S | D. | MgF2 |
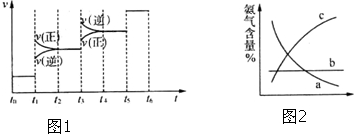
 ,化合物ABF的电子式为
,化合物ABF的电子式为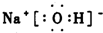 ;
;